Lexikon der Biologie: Chromosomen
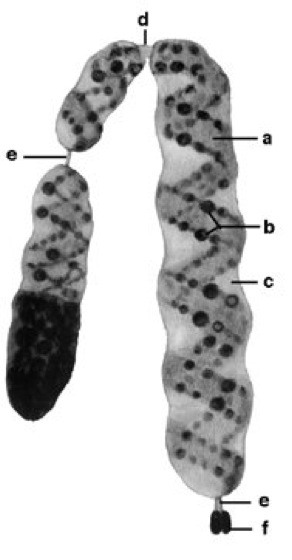
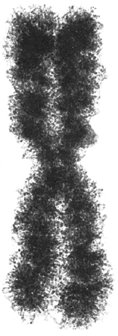
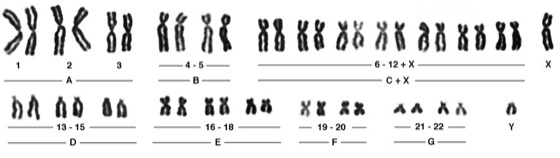
Chromosomen [von *chromosom -], Strukturen in den Zellkernen eukaryotischer Zellen (Eucyte, Zelle), die der Speicherung und Weitergabe der genetischen Information dienen (Chromosomentheorie der Vererbung). Der Begriff Chromosom bezog sich ursprünglich auf das stets vorhandene, mit basischen Farbstoffen leicht anfärbbare Material in Zellkernen, das in der Regel nur während Kernteilungen (Mitose, Meiose) lichtmikroskopisch darstellbar ist. Rein morphologisch beschreibend wurden die Chromosomen früher auch als Kernfäden bzw. Kernschleifen bezeichnet. – In den Chromosomen der Eukaryoten finden sich im wesentlichen DNA (Desoxyribonucleinsäuren; 10–30%), Struktur- bzw. Begleitproteine (40–75%) – Histone und Nicht-Histon-Proteine – sowie RNA (Ribonucleinsäuren; 3–15%). Die Menge der DNA eines Chromosoms ist konstant und artspezifisch, die der RNA variiert in Abhängigkeit der Transkriptionsaktivität der Zelle. Grundstruktur der Eucyten-Chromosomen ist eine DNA-Doppelhelix (Doppelstrang), die zu Beginn der Kernteilung durch Histone und Nicht-Histon-Proteine in einem komplizierten Organisationssystem aus mindestens vier übereinander gelagerten Verpackungen aufspiralisiert wird (Chromatinorganisation). Durch die mehrfache Spiralisierung kondensieren die dünnen, miteinander verschlungenen Chromosomenfäden zu stäbchenförmigen Strukturen, die nur noch etwa 1/10 000 (zwischen 1–50 μm) ihrer ursprünglichen Länge haben. In der Metaphase von Mitose und Meiose ist lichtmikroskopisch die Unterteilung der Chromosomen in zwei identische Längseinheiten, die Chromatiden, sichtbar, wobei jede Chromatide einen vollständigen und funktionsfähigen DNA-Doppelstrang darstellt. Die Chromatiden werden in der Anaphase voneinander getrennt und auf die Tochterkerne verteilt. Während der nächsten Interphase findet dann die identische Replikation der DNA der Chromosomen (bis zu diesem Zeitpunkt eigentlich der Chromatiden) statt, so daß in der nächsten Mitose bzw. Meiose erneut die zweigeteilte Struktur der Chromosomen zu sehen ist. Bei dem historisch bedingten, jedoch oft irreführenden Begriff Chromatiden handelt es sich also genaugenommen um identische Geschwisterchromosomen, die aus der DNA-Replikation hervorgegangen sind. – Die beiden Chromatiden eines Chromosoms hängen im Centromer ( vgl. Abb. 1), der Primäreinschnürung der Chromosomen und gleichzeitig dem Anlagerungspunkt der Kinetochor-Proteinkomplexe (Anheftungspunkte der Spindelfasern während der Zellteilung; Kinetochor), zusammen, wodurch die Chromosomen aus vier im Normalfall paarweise gleich langen Armen (Chromosomenarme) bestehen ( vgl. Abb. 2). Je nach Lage des Centromers kann man Chromosomen in der Metaphase lichtmikroskopisch unterscheiden ( vgl. Abb. 3): bei metazentrischen Chromosomen liegt das Centromer etwa in der Mitte, bei akrozentrischen zwischen Chromosomenmitte und dem Telomer (Chromosomenende, s. u.), bei telozentrischen nahe dem Telomer, bei subakrozentrischen oder submetazentrischen an eine der beiden letzteren Positionen angenähert. In der Metaphase entstehen in Abhängigkeit von der Lage des Centromers X- oder V-förmige Strukturen. Sind in Ausnahmefällen zwei Centromere auf einem Chromosom ausgebildet, so spricht man im Gegensatz zu den gewöhnlichen monozentrischen von dizentrischen Chromosomen. Viele Chromosomen besitzen auch eine sog. Sekundäreinschnürung. Diese Chromosomen wurden früher als SAT-Chromosomen bezeichnet, da man aufgrund negativer Feulgenscher Farbreaktion (Feulgensche Reaktion) fälschlicherweise glaubte, daß hier keine DNA vorhanden wäre (ohne DNA = sine acido thymonucleinico = SAT). Die auf diese Weise "abgeschnürten" Teile werden etwas irreführend Satelliten genannt (nicht zu verwechseln mit Satelliten-DNA), die Bezeichnung SAT-Chromosomen ist daher nach wie vor als Abk. für Satellitenchromosomen gebräuchlich. Der Bereich der Sekundäreinschnürung selbst ist für die Bildung des Nucleolus (Kernkörperchen) verantwortlich, weshalb er Nucleolus-Organisator genannt wird. Die Lage des Nucleolenbildungsortes ist genetisch determiniert. An den Enden der Chromosomen befinden sich die sog. Telomere – DNA-Sequenzen, die als Angriffspunkt der Telomerasen dienen. Sie verhindern die Verkürzung von Chromosomen beim Replikationsvorgang und die Verknüpfung von Chromosomen, außerdem schützen sie die Enden vor dem Angriff durch Nucleasen. Nach neueren Forschungsergebnissen an Mäusen (1999) liegen die Enden der Chromosomen von Säugern nicht, wie bislang aufgrund von Untersuchungen an Ciliaten (wie die Säugetiere Eukaryoten) angenommen, als lineare, sondern als schlaufenförmige Gebilde vor, die eine komplizierte Schutzstruktur aufweisen. – Drei Bestandteile – Telomer, Centromer und eine Mindestmenge an gewöhnlicher DNA – reichen aus, um ein künstliches Chromosom herzustellen, das sich in menschlichen Zellen repliziert, teilt und an Tochterzellen weitergegeben werden kann. – Während der Interphase liegen im stoffwechselaktiven Zellkern alle gerade aktivierten DNA-Abschnitte weitgehend entspiralisiert vor, die Chromosomen sind lichtmikroskopisch nicht sichtbar. Dabei werden zwei Formen des Chromatins unterschieden: weniger dicht gepacktes Euchromatin, dessen DNA gerade in RNA transkribiert wird, und dichter gepacktes, nach wie vor anfärbbares Heterochromatin, das nicht transkribiert wird. In der Prophase der Meiose treten als besonders gut anfärbbare Stellen auf den Chromosomen die sog. Chromomeren in Erscheinung, wobei es sich um lokale, knotenartige Verdickungen entlang der Chromatiden handelt, die durch zusätzliche Spiralisierung bedingt sind. Sie sind in heterochromatischen Bereichen größer als in euchromatischen. Chromomeren sind besonders gut im Pachytän-Stadium der Meiose sowie bei Riesenchromosomen und Lampenbürstenchromosomen erkennbar, wo sie als Bandenmuster auf den Chromosomen hervortreten. Die Anordnung der nach Größe und Form unterscheidbaren Chromomeren ist für jedes Chromosom charakteristisch. Der DNA-Gehalt von Chromosomen ist in den Chromomeren besonders hoch, während die dazwischenliegenden Interchromomeren-Abschnitte besonders reich an Histon- und Nicht-Histon-Proteinen sind. Nicht mit den Chromomeren zu verwechseln sind die individuellen Bandenmuster, die sich nach Vorbehandlung und Färbung mit AT- bzw. GC-Basen-spezifischen Farbstoffen (Basenzusammensetzung) auf Chromosomen darstellen lassen und die Basenverteilung (Basensequenz) auf der DNA widerspiegeln. Die sog. Q-Banden (Q-Bänderung) entsprechen z. B. AT-reichen Abschnitten (AT-Gehalt), die C-Banden zeigen hochrepetitive DNA-Sequenzen (repetitive DNA) an (sie liegen vor allem in Bereichen, die das Centromer umgeben, und entsprechen dem konstitutiven Heterochromatin). Des weiteren unterscheidet man noch zwischen G- (Giemsa-), G11-, T- (Telomer-), NOR- (Nucleolus-Organisator-), R- (Revers-) und Replikationsbänderung, je nach Art der Färbung. – Die Anzahl der Chromosomen pro Zellkern, der Chromosomensatz, ist für jeden Organismus charakteristisch ( vgl. Tab. 2–5 ). über haploide und diploide Chromosomenzahlen im Pflanzen- und Tierreich). Jedes Chromosom trägt einen Teil der genetischen Information. Die diploiden Körperzellen (Diploidie) des Menschen enthalten 46 Chromosomen ( vgl. Abb. 4), davon 44 Autosomen (liegen immer als Paar homologer Chromosomen vor, also 22 Paare) und 2 Heterosomen (Geschlechtschromosomen; weiblicher Genotyp = XX, männlicher Genotyp = XY; X-Chromosom, Y-Chromosom). Bei der Gametenbildung wird der Chromosomensatz im Verlauf der Meiose halbiert, so daß menschliche Gameten 22 Autosomen und 1 Geschlechtschromosom, X oder Y, besitzen. Die Chromosomen können nach Gestalt, Länge und Bandenausbildung nach spezifischer Anfärbung (Chromosomenfärbung) in Gruppen (Mensch: A–G) eingeteilt und zu einem Karyotyp angeordnet werden (vgl. Abb. 5, vgl. Tab. 1 ). Nah verwandte Arten haben oft ähnliche Chromosomenzahlen oder ein Vielfaches einer Grundmenge – ein Phänomen, dasdurch sog. Polyploidisierung zustande kommt. Polyploidisierung findet man vor allem bei Pflanzen. Heute angebaute Kulturpflanzen besitzen häufig den vervielfachten Chromosomensatz der ursprünglichen Wildform (z. B. hexaploider Weizen = Triticum; Wildtyp), aber auch an extremen Standorten, z. B. im Polargebiet (Polarregion), wild wachsende Pflanzen sind zum Teil polyploid (Polyploidie). Bei Tieren bleibt die Vervielfachung des Chromosomensatzes auf die Zellen bestimmter Gewebe beschränkt, was zur Mosaik-Bildung führt (Chromosomenmosaike). – Die auf den Chromosomen liegenden Gene (Gen) stellen die informationstragenden Einheiten dar, sie entsprechen je nach ihrer Größe kürzeren oder längeren, mikroskopisch jedoch nicht auflösbaren Teilbereichen der Chromosomen und sind in linearer, definierter Abfolge auf ihnen angeordnet. Die Hauptmasse der DNA auf den Chromosomen der Eukaryoten ist allerdings nicht-informationstragend bzw. nicht-codierend, beim Menschen bestehen beispielsweise nur zwei bis drei Prozent aus codierender DNA (Genmosaikstruktur, Prozessierung, spleißen). Gemeinsam auf einem Chromosom liegende Gene bilden eine Koppelungsgruppe. Die einer Koppelungsgruppe angehörenden Gene sind bei der Meiose nicht in dem Maße frei rekombinierbar wie auf verschiedenen Chromosomen liegende Gene, sondern werden vorzugsweise gemeinsam auf die Tochterzellen verteilt. Die Rekombination gekoppelter Gene erfolgt in der Meiose durch Crossing over (Koppelungsbruch) zwischen zwei homologen Chromosomen, d. h. gleichen, aber aus verschiedenen Eltern stammenden Chromosomen. Die Austauschhäufigkeit zwischen zwei verschiedenen, auf homologen Chromosomen liegenden Genen dient als Maß für den relativen Abstand dieser Gene auf der Koppelungsgruppe. Mit Hilfe der aus einer großen Zahl von Kreuzungen ermittelten Austauschhäufigkeiten kann die relative Anordnung von Genen auf einem Chromosom ermittelt werden. So wurden z. B. die Verteilung und relative Anordnung von Genen auf den vier Chromosomen (im haploiden Genom) von Drosophila melanogaster bestimmt ( Chromosomen II ). Das Ergebnis solcher Kreuzungsanalysen wird in einer Chromosomenkarte ( Chromosomenkarte I
Chromosomenkarte II
Chromosomenkarte III
Chromosomenkarte IV
) oder Genkarte zusammengefaßt, die nicht nur die Zuordnung der Gene zu den jeweiligen Chromosomen, sondern auch deren relative Lage auf den Chromosomen wiedergibt. Die Erstellung von Genkarten zählt zu den klassischen Methoden der Genetik und wurde außer bei Drosophila an vielen anderen Organismen des Tier- und Pflanzenreichs durchgeführt, z. B. bei dem Nematoden Caenorhabditis elegans, der Maus und dem Kreuzblütler Arabidopsis thaliana (Schmalwand). Beim Menschen verbietet sich aus ethischen Gründen (Bioethik) eine experimentelle Kreuzungsanalyse. Neuere Methoden der Zuordnung von Genen zu einzelnen menschlichen Chromosomen sind die in-situ-Hybridisierung zwischen radioaktiv markierter RNA und DNA (Markierung) in Chromosomen isolierter Zellen sowie die Analyse von Hybridzellen (meist aus Maus- und Menschenzellen), die durch Zellfusionen entstehen. (Bei den anschließenden Zellteilungen gehen bevorzugt menschliche Chromosomen verloren, wobei der Verlust bestimmter biochemischer Leistungen dem Verlust bestimmter Chromosomen zugeordnet werden kann.) Die relative Lage der Gene (Genloci; Genort) wird u. a. durch die Analyse künstlich erzeugter Chromosomenaberrationen ermittelt. Beispielsweise kann die Häufigkeit bestimmt werden, mit der Gene eine gemeinsame Translokation erfahren, woraus der relative Abstand der betreffenden Gene abgeschätzt werden kann (je näher zwei Gene zueinander benachbart sind, desto häufiger erfolgt gemeinsame Translokation). Im Rahmen des Genomprojekts, das bereits zur vollständigen Sequenzierung der Genome mehrerer Arten beigetragen hat, wird inzwischen verstärkt an der Erstellung einer Karte des menschlichen Genoms gearbeitet. Mit Hilfe von Koppelungsanalysen (genetische Kartierung) erfolgte eine erste Lokalisierung von mindestens 3000 genetischen Markern auf den Chromosomen, bei der physischen Kartierung wurde deren Position durch die Anordnung von Chromosomenfragmenten bestimmt. In der Sequenzanalyse erfolgt nun die Bestimmung der genauen Nucleotidfolge der DNA jedes Chromosoms (beim Menschen ca. 3 Milliarden Basenpaare im haploiden Chromosomensatz). – Prokaryotische Zellen (Protocyte) enthalten in einem als Nucleoid bezeichneten kernähnlichen, nicht von einer Membran umgebenen Bereich ein sog. Bakterienchromosom oder Genophor, das sich von den Chromosomen eukaryotischer Zellen grundlegend unterscheidet. Es liegt nicht als linearer DNA-Doppelstrang, sondern als geschlossener DNA-Ring vor, der nur in geringem Maß mit Begleitproteinen und RNA assoziiert und aufgrund innerer Spannungen der Ringform zu einem sog. "Supertwist" (supercoil) verdrillt ist. Im genetischen Sinne stellen Bakterienchromosomen – wie die Chromosomen der Eukaryoten (für die die Bezeichnung Chromosomen ursprünglich eingeführt wurde) – Koppelungsgruppen dar. Zur Gentherapie: vgl. Infobox. – Bedeutende Beiträge zur Erforschung der Chromosomen leisteten u. a. E. van Beneden, T. Boveri, C.B. Bridges, C.D. Darlington, J.L.H. Down, W. Flemming, O.W.H. Hertwig, W.F.B. Hofmeister, A. Klug, T.H. Morgan, C.W. von Naegeli, W. Roux, E.A. Strasburger, H.W.G. von Waldeyer-Hartz, A.F.L. Weismann, E.B. Wilson. – chromosome jumping, Chromosomenanomalien, Chromosomenbänderungstechnik, Chromosomenfusion, Chromosomenpaarung, Chromosomenpolymorphismus, chromosome walking, Cytogenetik, Cytologie, Double-Minute-Chromosomen, Erbkrankheiten (Tab.), Genomprojekt, Gentechnologie, Gonomerie, Grundzahl, Harlekin-Chromosomen, Mendelsche Regeln (Farbtafel), Morgan-Gesetze, Ringchromosomen, scaffold, Spindelapparat; Chromosomenkarte I
Chromosomenkarte II
Chromosomenkarte III
Chromosomenkarte IV
, Replikation der DNA II. Chromosomen I , Chromosomen II .
G.St./S.Kl./M.B./P.E.
Lit.: Adolph, K.W.: Chromosomes & Chromatin. Boca Raton 1987. Adolph, K.W. (ed.): Molecular Biology of Chromosome Function. Berlin 1989. Bickmore, W.A., Craig, J.: Chromosome Bands. Patterns in the Genome. Berlin 1997. Chadwick, D.J., Cardew, G. (ed.): Telomeres and Telomerase. New York 1998. Murken, J.D., Wilmowsky, H. von: Die Chromosomen des Menschen. Die Geschichte ihrer Erforschung. München 1973. Seyffert, W. (Hrsg.): Lehrbuch der Genetik. Stuttgart 1998. Traut, W.: Chromosomen. Klassische und molekulare Cytogenetik. Berlin 1991. Wagner, R.P., Maguire, M.P., Stallings, R.L.: Chromosomes – a synthesis. New York 1993.
| ||
| Crepis capillaris (Grüner Pippau) | 6 | |
| Cucumis sativus (Gurke) | 14 | |
| Allium cepa (Küchenzwiebel) | 16 | |
| Zea mays (Mais) | 20 | |
| Abies alba (Weißtanne) | 24 | |
| Pinus sylvestris (Waldkiefer) | 24 | |
| Cucurbita pepo (Kürbis) | 40 | |
| Nicotiana tabacum (Tabak) | 48 | |
| Solanum tuberosum (Speisekartoffel) | 48 | |
| Cladophora glomerata (Grünalge) | 64 | |
| Botrychium lunaria (Gemeine Mondraute) | 90 | |
| Cryptogramma crispa (Krauser Rollfarn) | 120 | |
| Lycopodiella inundata (Gemeiner Moorbärlapp) | 156 | |
| Polypodium interjectum (Gesägter Tüpfelfarn) | 222 | |
| Ophioglossum vulgatum (Gemeine Natternzunge) | 480 | |
| TIERE | ||
| Ascaris megalocephala (Pferdespulwurm) | 4 | |
| Aedes canadensis (Stechmücke) | 6 | |
| Drosophila melanogaster (Taufliege) | 8 | |
| Entamoeba histolytica (Ruhramöbe) | 12 | |
| Fasciola hepatica (Großer Leberegel) | 12 | |
| Apis mellifera (Honigbiene) | 16 | |
| Esox lucius (Hecht) | 18 | |
| Daphnia magna (Großer Wasserfloh) | 20 | |
| Hyla arborea (Laubfrosch) | 24 | |
| Sycon ciliatum (Wabenkalkschwamm) | 26 | |
| Stentor coerculeus (Trompetentierchen) | 28 | |
| Alligator mississippiensis (Mississippialligator) | 32 | |
| Lumbricus terrestris (Regenwurm) | 36 | |
| Felis silvestris f.domestica (Hauskatze) | 38 | |
| Mus musculus musculus (Hausmaus) | 40 | |
| Rattus norvegicus (Wanderratte) | 42 | |
| Homo sapiens (Mensch) | 46 | |
| Ascaris lumbricoides (Menschenspulwurm) | 48 | |
| Helix pomatia (Weinbergschnecke) | 54 | |
| Bombyx mori (Seidenspinner) | 56 | |
| Bos primigenius f.taurus (Hausrind) | 60 | |
| Cavia porcellus (Meerschweinchen) | 64 | |
| Gallus gallus gallus (Haushuhn) | 78 | |
| Canis lupus f.familiaris (Haushund) | 78 | |
| Carassius auratus (Goldfisch) | 94 | |
| Cyprinus carpio (Karpfen) | 104 |
Tab. 3: Diploide Chromosomenzahlen (mitotische Metaphase) im Tierreich, systematisch sortiert
| ||
| Entamoeba histolytica (Ruhramöbe) | 12 | |
| Stentor coerculeus (Trompetentierchen) | 28 | |
| Porifera (Schwämme) | ||
| Spongilla lacustris (Teichschwamm) | 10–12 | |
| Sycon ciliatum (Wabenkalkschwamm) | 26 | |
| Mesozoa (Mitteltiere) | ||
| Rhopalura ophiocomae | 6 | |
| Cnidaria (Nesseltiere) | ||
| Aurelia flavedula (Ohrenqualle) | 18–20 | |
| Plathelminthes (Plattwürmer) | ||
| Dendrocoelum lacteum (Strudelwurm) | 16 | |
| Fasciola hepatica (Großer Leberegel) | 12 | |
| Nemathelminthes (Schlauchwürmer) | ||
| Ascaris lumbricoides (Menschenspulwurm) | 48 | |
| Ascaris megalocephala (Pferdespulwurm) | 4 | |
| Asplanchna intermedia (Sackrädertier) | 24 | |
| Annelida (Ringelwürmer) | ||
| Glossiphonia complanata (Großer Schneckenegel) | 26 | |
| Lanice conchylega (Muschelsammlerin) | 6 | |
| Lumbricus terrestris (Regenwurm) | 36 | |
| ARTHROPODA (Gliederfüßer) | ||
| Tardigrada (Bärtierchen) | ||
| Macrobiotus lacustris | 10 | |
| Crustacea (Krebstiere) | ||
| Cyclops modestus (Hüpferling) | 8 | |
| Daphnia magna (Großer Wasserfloh) | 20 | |
| Diaptomus coerculus (Ruderfußkrebs) | 28 | |
| Insecta (Insekten) | ||
| Aedes canadensis (Stechmücke) | 6 | |
| Apis mellifera (Honigbiene) | 16 | |
| Bombyx mori (Seidenspinner) | 56 | |
| Culex pipiens (Gemeine Stechmücke) | 6 | |
| Drosophila melanogaster (Taufliege) | 8 | |
| Dytiscus marginalis (Gelbrandkäfer) | 38 | |
| Lasius flavus (Gelbe Wiesenameise) | 24 | |
| Podura aquatica (Springschwanz) | 8 | |
| Tenebrio molitor (Mehlkäfer) | 20 | |
| Musca domestica (Hausfliege) | 12 | |
| Mollusca, Gastropoda (Weichtiere, Schnecken) | ||
| Helix pomatia (Weinbergschnecke) | 54 | |
| Echinodermata (Stachelhäuter) | ||
| Asterias vulgaris (Gemeiner Seestern) | 18 | |
| Echinus acutus (Seeigel) | 38 | |
| Acrania (Schädellose) | ||
| Branchiostoma lanceolatum (Lanzettfischchen) | 24 | |
| VERTEBRATA (Wirbeltiere) | ||
| Cyclostomata (Rundmäuler) | ||
| Myxine glutinosa (Inger) | 50–52 | |
| Osteichthyes (Knochenfische) | ||
| Carassius auratus (Goldfisch) | 94 | |
| Cyprinus carpio (Karpfen) | 104 | |
| Esox lucius (Hecht) | 18 | |
| Amphibia, Urodela (Amphibien, Schwanzlurche) | ||
| Ambystoma mexicanum (Axolotl) | 28 | |
| Bufo bufo (Erdkröte) | 22 | |
| Hyla arborea (Laubfrosch) | 24 | |
| Xenopus laevis (Glatter Krallenfrosch) | 36 | |
| Reptilia (Reptilien) | ||
| Alligator mississippiensis (Mississippialligator) | 32 | |
| Testudo graeca (Maurische Landschildkröte) | 54–60 | |
| Vipera aspis (Aspisviper) | 42 | |
| Aves (Vögel) | ||
| Anser albifrons (Bläßgans) | 82 | |
| Columba livia f. domestica (Haustaube) | 80 | |
| Gallus gallus gallus (Haushuhn) | 78 | |
| Mammalia (Säugetiere) | ||
| Bos primigenius f. taurus (Hausrind) | 60 | |
| Canis lupus f. familiaris (Haushund) | 78 | |
| Capra aegagrus f. hircus (Hausziege) | 60 | |
| Cavia porcellus (Meerschweinchen) | 64 | |
| Cricetulus griseus (Chinesischer Zwerghamster) | 22 | |
| Equus przewalskii f. caballus (Hauspferd) | 64 | |
| Felis silvestris f. domestica (Hauskatze) | 38 | |
| Gorilla gorilla (Gorilla) | 48 | |
| Homo sapiens (Mensch) | 46 | |
| Hylobates spec. (Gibbon) | 52 | |
| Macaca mulatta (Rhesusaffe) | 48 | |
| Mesocricetus auratus (Syrischer Goldhamster) | 44 | |
| Mus musculus musculus (Hausmaus) | 40 | |
| Oryctolagus cuniculus (Kaninchen) | 44 | |
| Ovis ammon f.aries (Hausschaf) | 54 | |
| Pan troglodytes (Schimpanse) | 48 | |
| Pongo pygmaeus (Orang-Utan) | 48 | |
| Rattus norvegicus (Wanderratte) | 42 | |
| Sus scrofa (Wildschwein) | 38 |
Tab. 4: Diploide Chromosomenzahlen (mitotische Metaphase) im Pflanzenreich, systematisch sortiert.
Angaben über Chromosomenzahlen, die Vielfache einer Basiszahl darstellen, zeigen Polyploidisierung an
| ||
| Lycopodiatae (Bärlappe) | ||
| Diphasium complanatum (Gemeiner Flachbärlapp) | 46 | |
| Isoetes lacustris (Seebrachsenkraut) | 110 | |
| Lycopodiella inundata (Gemeiner Moorbärlapp) | 156 | |
| Lycopodium clavatum (Keulenbärlapp) | 68 | |
| Selaginella helvetica (Schweizer Moosfarn) | 18 | |
| Selaginella selaginoides (Dorniger Moosfarn) | 18 | |
| Equisetatae (Schachtelhalme) | ||
| Equisetum pratense (Wiesenschachtelhalm) | 216 | |
| Equisetum sylvaticum (Waldschachtelhalm) | 216 | |
| Filicatae (Farne) | ||
| Adiantum capillus-veneris (Frauenhaarfarn) | 60 | |
| Asplenium ruta-muraria (Mauerstreifenfarn, Mauerraute) | 72 | |
| Asplenium trichomanes (Braunstieliger Streifenfarn) | 72 | |
| Athyrium filix-femina (Frauenfarn) | 80 | |
| Azolla caroliniana (Kleiner Algenfarn) | 48 | |
| Blechnum spicant (Gemeiner Rippenfarn) | 68 | |
| Botrychium lunaria (Gemeine Mondraute) | 90 | |
| Cryptogramma crispa (Krauser Rollfarn) | 120 | |
| Cystopteris fragilis (Zerbrechlicher Blasenfarn) | 168 | |
| Dryopteris affinis ssp. borreri (Schuppiger Wurmfarn) | 82 | |
| Dryopteris filix-mas (Gemeiner Wurmfarn) | 164 | |
| Gymnocarpium dryopteris (Echter Eichenfarn) | 160 | |
| Marsilea quadrifolia (Vierblättriger Kleefarn) | 40 | |
| Ophioglossum vulgatum (Gemeine Natternzunge) | 480 | |
| Polypodium interjectum (Gesägter Tüpfelfarn) | 222 | |
| Polypodium virginianum (Virginischer Tüpfelfarn) | 74, 148 | |
| Polypodium vulgare (Gemeiner Tüpfelfarn, Engelsüß) | 148 | |
| Salvinia natans (Gemeiner Schwimmfarn) | 18 | |
| Thelypteris limbosperma (Berglappenfarn) | 68 | |
| Thelypteris phegopteris (Buchenfarn) | 90 | |
| SPERMATOPHYTA (Samenpflanzen) | ||
| Coniferophytina (Gabel- und Nadelblättrige Nacktsamer) | ||
| Abies alba (Weißtanne) | 24 | |
| Ginkgo biloba (Ginkgo) | 24 | |
| Picea abies (Fichte) | 24 | |
| Pinus sylvestris (Waldkiefer) | 24 | |
| Sequoia sempervirens (Küstenmammutbaum) | 66 | |
| Taxus baccata (Beeren-Eibe) | 24 | |
| Magnoliophytina (Bedecktsamer, Angiospermen) | ||
| Allium cepa (Küchenzwiebel) | 16 | |
| Allium oleraceum (Gemüse-Lauch) | 32, 40 | |
| Arabidopsis thaliana (Ackerschmalwand) | 10 | |
| Asparagus officinalis (Gartenspargel) | 20, 40 | |
| Avena sativa (Saathafer) | 42 | |
| Beta vulgaris (Wildbete) | 18 | |
| Cocos nucifera (Kokospalme) | 32 | |
| Crepis capillaris (Grüner Pippau) | 6 | |
| Cucumis sativus (Gurke) | 14 | |
| Cucurbita pepo (Kürbis) | 40 | |
| Daucus carota (Möhre) | 18 | |
| Digitalis purpurea (Roter Fingerhut) | 56, 112 | |
| Elodea canadensis (Wasserpest) | 24, 48 | |
| Fagus sylvatica (Rotbuche) | 24 | |
| Glycine max (Sojabohne) | 40 | |
| Helianthus annuus (Sonnenblume) | 34 | |
| Hevea brasiliensis (Parakautschukbaum) | 36 | |
| Hordeum vulgare (Gerste) | 14 | |
| Juglans regia (Echter Walnußbaum) | 32 | |
| Lactuca sativa (Kopfsalat) | 18 | |
| Malus sylvestris (Apfel) | 34, 51 | |
| Medicago sativa (Luzerne) | 16, 32, 64 | |
| Nicotiana tabacum (Tabak) | 48 | |
| Oryza sativa (Reis) | 24, 48 | |
| Phaseolus vulgaris (Gartenbohne) | 22 | |
| Pisum sativum (Erbse) | 14, 28 | |
| Populus tremula (Zitterpappel, Espe) | 38 | |
| Pyrus communis (Birne) | 34, 51 | |
| Ribes sp. (Johannis-/Stachelbeere) | 16 | |
| Secale cereale (Roggen) | 14 | |
| Solanum tuberosum (Speisekartoffel) | 48 | |
| Trifolium pratense (Roter Wiesenklee) | 14, 28, 56 | |
| Triticum aestivum (Saatweizen) | 42 | |
| Triticum durum (Hartweizen) | 28 | |
| Vitis vinifera (Weinrebe) | 38, 57, 76 | |
| Zea mays (Mais) | 20 |
Tab. 5: Haploide Chromosomenzahlen bei eukaryotischen Algen, Moosen und Pilzen, systematisch sortiert
| ||
| Xanthophyceae (Gelbgrünalgen) | ||
| Vaucheria sessilis | 7–10 | |
| Phaeophyceae (Braunalgen) | ||
| Fucus vesiculosus (Blasentang) | 10, 32 | |
| Laminaria digitata (Fingertang) | 27–31 | |
| CHLOROPHYTA (Grünalgen) | ||
| Acetabularia wettsteinii (Schirmalge) | ca. 10 | |
| Cladophora glomerata | 32, 48 | |
| Ulothrix zonata | 4, 10 | |
| RHODOPHYTA (Rotalgen) | ||
| Polysiphonia nigrescens | 30 | |
| BRYOPHYTA (Moose) | ||
| Anthocerotatae (Hornmoose) | ||
| Anthoceros laevis (Glattes Hornmoos) | 6 | |
| Marchantiatae (Lebermoose) | ||
| Marchantia polymorpha (Gemeines Brunnenlebermoos) | 9 | |
| Riccia fluitans (Untergetauchtes Sternlebermoos) | 8 | |
| Bryatae (Laubmoose) | ||
| Andreaea rothii (Felsenklaffmoos) | 10, 11 | |
| Funaria hygrometrica (Echtes Drehmoos) | 14, 28, 56 | |
| Mnium cuspidatum (Spieß-Sternmoos) | 6, 12 | |
| Polytrichum commune (Gemeines Widertonmoos) | 7 | |
| Sphagnum palustre Sumpftorfmoos) | 38+4? | |
| MYCOTA (Pilze) | ||
| Myxomycetes (Echte Schleimpilze) | ||
| Cladosterma debaryanum | 8–10 | |
| Phycomycetes (Algenpilze) | ||
| Rhizopus stolonifer | 16 | |
| Ascomycetes (Schlauchpilze) | ||
| Neurospora crassa (Roter Brotschimmel) | 7 | |
| Saccharomyces cerevisiae (Bierhefe) | ca. 16 | |
| Venturia inaequalis (Apfelschorf-Erreger) | 4–6, 7 | |
| Basidiomycetes (Ständerpilze) | ||
| Agaricus campestris (Wiesenchampignon) | 12 | |
| Amanita fulva (Rotbrauner Scheidenstreifling) | 8 | |
| Puccinia sp. (Rostpilz) | 3–6 |


Schreiben Sie uns!