Lexikon der Biologie: Chronobiologie
ESSAY
Edgar Wagner
Chronobiologie
Chronobiologie I
Chronobiologie II
Die Chronobiologie beschreibt und erforscht die Zeitstruktur von Lebewesen, von Einzellern und komplexen Organismen, von Populationen und Ökosystemen. Der Aufbau von Struktur und Funktion der Lebewesen vollzieht sich in einem präzisen zeitlichen Raster periodisch sich wiederholender Vorgänge oder physiologischer Rhythmen. Oszillationen (Schwingung) können auf allen Organisationsstufen des Lebens beobachtet werden und scheinen eine grundlegende Eigenschaft allen Lebens zu sein (biologische Oszillationen). Der Funktionszustand von Einzelzellen oder Geweben, die Aktivität von Enzymen, die Wirkung von Hormonen, die Tätigkeit von Organen oder physiologischen Systemen, wie Photosynthese, Atmung oder Blutkreislauf, die Ansprechbarkeit auf Gifte und Arzneimittel sowie die physische und psychische Leistungsfähigkeit sind zeitlichen Veränderungen unterworfen, die sich mit einer bestimmten Periodik wiederholen. Ziel der Chronobiologie ist die Erforschung der Ursachen und der praktischen Bedeutung der zeitlichen Organisation von Lebewesen.
Das Frequenzspektrum biologischer Rhythmen reicht vom Millisekundenbereich über Stunden und Tage bis zu Monaten und Jahren ( vgl. Tab. 1). Im wesentlichen zeigen zyklische biologische Prozesse und Funktionen eine Periodik, die synchron mit periodischen Schwankungen von Außenfaktoren läuft. Besonders wirksam sind geophysikalische Zyklen ( vgl. Tab. 2), die aus den Relativbewegungen von Sonne, Mond und Erde resultieren, wie der Wechsel von Tag und Nacht, der Gezeitenwechsel und der Mondphasenwechsel oder der Wechsel der Jahreszeiten. Die Organismen folgen nicht passiv den Umweltzyklen, sondern haben im Laufe der Evolution entsprechend der Außenrhythmik endogene Rhythmen entwickelt. Rhythmisches Verhalten biologischer Systeme ist systemimmanent und war offenbar von großem Selektionsvorteil (Selektion). Die Biorhythmen erlauben es den Organismen, sich an geophysikalische Periodizitäten anzupassen, sich in Populationen zu koordinieren und ihre interne Zeitstruktur durch Synchronisation mit den Außenzyklen zu stabilisieren. Geophysikalische, ökologische und soziale Umwelt-Periodizitäten wirken als Synchronisatoren auf die endogenen biologischen Oszillatoren zellulären Ursprungs ein. Die Frequenzen der biologischen Oszillatoren haben sich im Laufe der biologischen Evolution ungefähr den wesentlichsten Umweltzyklen angeglichen, so daß sie durch diese im Rahmen eines bestimmten Mitnahmebereichs synchronisiert werden können. Außenrhythmen, die eine endogene Periodik synchronisieren, nicht aber Ursache dieser Periodik sind, werden als Zeitgeber (J. Aschoff, 1951) bezeichnet. Die wichtigsten Zeitgeber sind Licht und Temperatur. Licht (Lichtfaktor) wird von speziellen Photorezeptoren wahrgenommen (Photorezeption): bei Pflanzen im wesentlichen durch Phytochrom (Phytochrom-System) und Blaulicht absorbierende Pigmente (Cryptochrome; Blaulichtrezeptor); bei Tieren über die Augen (Sehfarbstoffe) oder das Parietalauge oder über Photorezeptoren in der Epiphyse (Pinealorgan), direkt im Gehirn oder über die Haut (Cryptochrom; Hautlichtsinn). Für die in den Erbanlagen programmierte und über den Stoffwechsel realisierte Circa-24-Stunden-Periodik hat F. Halberg 1954 den Begriff "circadian" (circa = ungefähr; dies = Tag) eingeführt.
Circadiane Rhythmen (circadiane Rhythmik) in Geweben oder Organen bestehen fort, wenn diese aus einem Organismus isoliert werden. Aus der Übereinstimmung der Rhythmen in Einzellern und in den Geweben von Pflanzen und Tieren ergibt sich, daß für den rhythmischen Primärprozeß nur ein intrazellulärer Mechanismus der Zelle in Frage kommt. Er muß als Systemeigenschaft der gesamten Zelle aufgefaßt werden, da er nicht in isolierten Subsystemen der Zelle, wie etwa den Mitochondrien oder dem Zellkern, gefunden werden konnte. Bestenfalls läßt er sich mit dem Netzwerk des gesamten Energiestoffwechsels korrelieren (s. u.). Bei der Synchronisation zellulärer Oszillation in Geweben und Organen des gesamten Organismus spielen neurale und humorale Funktionen eine entscheidende Rolle. Die durch den Tagesrhythmus ermöglichte Chronometrie (innere Uhr) ist die Grundlage sowohl zeitlicher und räumlicher Orientierung (Sonnenkompaß; Kompaßorientierung) als auch der Synchronisation von Entwicklungs- und Fortpflanzungszyklen im Lunar- und Jahresrhythmus, z. B. bei der Meeresmücke Clunio (Zuckmücken) und dem Palolowurm (Palolowürmer, Lunarperiodizität) der Südsee oder der photoperiodischen Steuerung (s. u.) der Blütenbildung. Die Synchronisation an die äußeren Zeitgeber bedeutet eine Frequenzsynchronisation der circadianen Rhythmik ( vgl. Abb. 1) und keine Phasensynchronisation. Die Phasenlage der einzelnen Tagesrhythmen eines Organismus zur Umweltperiodik und zueinander gehorcht einer funktionalen Ordnung, die als circadiane Organisation bezeichnet wird. Unter Bedingungen externer Desynchronisation durch unphysiologische Zeitgeberzyklen oder Ausschaltung aller äußeren Zeitgeber in konstanten Laborbedingungen kann eine interne Desynchronisation entstehen, die zu chronopathologischen Reaktionen sowohl bei Pflanzen als auch bei Tieren und Menschen führt. Solche "Desynchronosen" werden z. B. beobachtet nach transmeridionalen Flügen (jet-lag) und durch Schichtarbeit. Durch eine "Chronodiät" oder eine Ganzkörper-Bestrahlung im Rhythmus des lokalen Licht-Dunkel-Wechsels ist es möglich, die Stoffwechseldesynchronisation gezielt zu behandeln.
Die Steuerung von Wachstum, Entwicklung und Verhalten von Pflanzen, Tieren und Menschen in Abhängigkeit von der jahreszeitlichen Änderung der Tageslänge ( vgl. Tab. 3) stellt eine der bedeutendsten Anpassungen der Organismen dar, den Photoperiodismus. Die Erforschung des Photoperiodismus hat wesentlich zur Beschreibung der inneren Uhr und ihrer Wechselwirkung mit Photorezeptoren beigetragen. Die Organismen registrieren über Photorezeptoren den Licht-Dunkel-Wechsel und messen die Tageslänge mit Hilfe der circadianen Rhythmik. Das Studium der biologischen Uhr in pflanzlichen und tierischen Einzellern hat gezeigt, daß die circadiane Rhythmik eine Systemeigenschaft der Zelle ist, die sie auf allen Organisationsstufen von Cyanobakterien (Blaualgen) bis zu Pflanzen, Tieren und Menschen beibehalten hat ( vgl. Infobox ). Die circadiane Rhythmik ist eine Funktion des gesamten Stoffwechselgefüges der Zelle. Sie läßt sich nicht in isolierten Zellorganellen beobachten. Ihre Frequenz ist weitgehend unabhängig von der Umgebungstemperatur ( vgl. Tab. 4). Diese Stabilität oder Homöostase der Periodenlänge ist eine wichtige Voraussetzung dafür, daß die circadiane Rhythmik als präzise physiologische Uhr wirkt und selbst Änderungen der Tageslänge von nur 5 Minuten pro Woche noch messen kann.
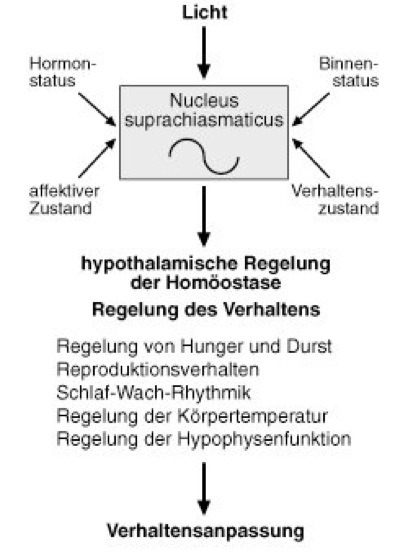
Da die circadiane Rhythmik eine Systemeigenschaft der Zelle ist, müssen in Vielzellern (Metazoa) die einzelnen Zellen, Gewebe und Organe zur endogenen Rhythmik des Organismus synchronisiert werden. Die in den Blattbewegungen (z. T. auch Blütenbewegungen) von Pflanzen ( vgl. Abb. 2) oder der Lauf-Aktivität von Tieren zum Ausdruck kommende circadiane Periodik beruht entweder auf einer Interaktion vieler Oszillatoren zu einer gemeinsamen Frequenz oder auf der Schrittmacherfunktion bestimmter Zellen oder Gewebe. Gerade bei tierischen Systemen findet sich häufig ein zentral-nervös lokalisierter Schrittmacher (Nucleus suprachiasmaticus, Pinealorgan; vgl. Abb. 3). Beim Ausfall des übergeordneten Schrittmachers können einzelne Gewebe oder Organe eine eigene Periodizität ausprägen und zu einer Desynchronisation der zeitlichen Organisation des Lebewesens führen, die unter Umständen den Zusammenbruch des Organismus zur Folge hat.
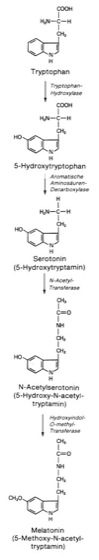
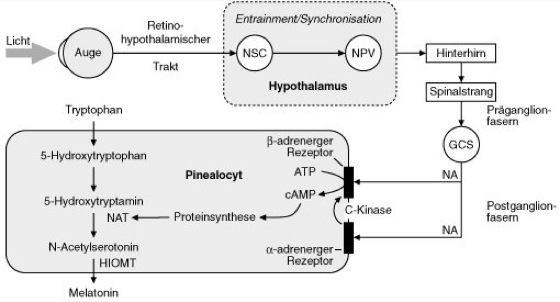
Bei Wirbeltieren kommt dem Pinealorgan eine zentrale Bedeutung bei der Übersetzung von photoperiodischen Signalen in eine Umsteuerung des Stoffwechsels zu ( vgl. Abb. 4). Bei Niederen Wirbeltieren, wie Fischen, Amphibien und Reptilien, ist das Pinealorgan vorwiegend Photorezeptor, dessen elektrische Aktivität in Abhängigkeit von der Belichtung wechselt. Bei Vögeln zeigt das Pinealorgan eine circadiane Rhythmik, ist Photorezeptor und kontrolliert höchstwahrscheinlich die Bewegungsaktivität und die Körpertemperatur durch die Sekretion des Hormons Melatonin. Bei Säugetieren ist das Pinealorgan (Epiphyse, Zirbeldrüse) eine Drüse, die nicht auf direkte Beleuchtung reagiert, jedoch über Signale, die von den Augen kommen, gesteuert wird. Die Produktion von Melatonin wird über eine Rhythmik des Schlüsselenzyms N-Acetyl-Transferase geregelt ( vgl. Abb. 5). Auch beim Menschen wird eine photoperiodische Steuerung der Melatoninproduktion beobachtet ( vgl. Abb. 6). Eine circadian-rhythmische Organisation des Energiestoffwechsels könnte die Basis für eine circadiane Rhythmik der Photostimulierbarkeit membrangebundener Photorezeptoren sein. Grundlage für diese Regulation sind die Membransysteme der Zelle (Membran), die einerseits die Reaktionsräume trennen (Kompartimentierung), andererseits die dadurch kompartimentierten Stoffwechselsequenzen über Transportmechanismen koppeln (Carrier, Membrantransport). Dadurch werden die Membranen zu Informationsübermittlern, sowohl zwischen den Kompartimenten als auch zwischen der Zelle und ihrer Umwelt. Der physikalische Zustand der Membran (Plasmamembran) kann die Transkription (Genaktivität) regeln. Die Kopplung der verschiedenen Sequenzen des Energiestoffwechsels, z. B. von Glykolyse und oxidativer Phosphorylierung (Atmungskettenphosphorylierung), kann durch Modulation von Enzymaktivitäten (Enzyme) durch Adenin- und Pyridinnucleotide sowie durch Verfügbarkeit von Ionen und Substraten bewerkstelligt werden. Die experimentellen Daten zeigen, daß bei einer endogen-rhythmischen Organisation der wesentlichen Sequenzen des Energiestoffwechsels eine circadiane Rhythmik der Energieladung und des Redox-Zustands (Redoxreaktionen) des Gesamtsystems zu beobachten ist. Aus der Photomodulation von Rhythmen der Enzymaktivität wird geschlossen, daß Licht die oszillierende Energietransduktion modulieren kann – unter Bedingungen, unter denen der integrierte Energiestoffwechsel circadian rhythmisch pulsiert. Es besteht die Möglichkeit, daß eine circadiane Rhythmik im Energiestoffwechsel die Grundlage photoperiodischer Zeitmessung ist und daß die Rhythmik der Empfindlichkeit membrangebundener Photorezeptoren auf einer circadianen Rhythmik im Energiezustand der Membran beruht. Auf dieser Basis kann eine Rhythmik im Energiestoffwechsel das Wachstum und die Differenzierung sowie das Verhalten zeitlich und räumlich koordinieren und kontrollieren. Eine circadiane Rhythmik und Photoregulation der Proteinsynthese konnte auf dem Niveau der Transkription (Aktivierung und Inaktivierung von Kern- und Plastidengenen) und Translation in Monokotylen (Einkeimblättrige Pflanzen) und Dikotylen (Zweikeimblättrige Pflanzen) nachgewiesen werden ( vgl. Tab. 5).
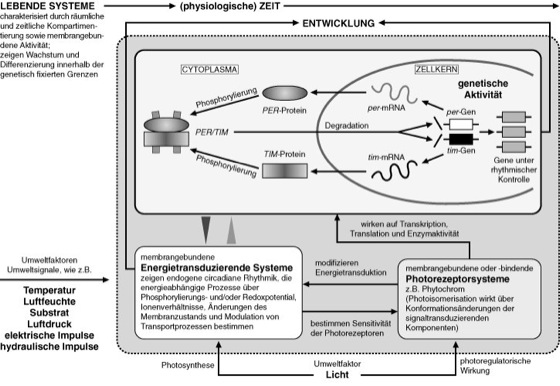
Die Aufklärung der molekularen Mechanismen der endogenen Zeitmessung hat besonders von Rhythmikmutanten von Drosophila melanogaster und Neurospora profitiert. Es konnte z. B. gezeigt werden, daß Genprodukte für die Synthese von Komponenten der circadianen Rhythmik von Drosophila verantwortlich sind. Aus einem Zusammenwirken der durch die Gene period (per) und timeless (tim) codierten Proteine mit ihrer eigenen mRNA kommt es zu Rhythmen der Protein- und Transkriptgehalte im Tagesverlauf, die sich auch unter konstanten Außenbedingungen fortsetzen. Die maximalen Konzentrationen der PER- und TIM-Proteine sind zum maximalen Gehalt an per- und tim-mRNA zeitlich verschoben. Grundlage für dieses Zeitverhalten ist eine autoregulatorische negative Rückkopplung. PER und TIM bilden ein Heterodimer, das am Ende der Lichtphase aus dem Cytoplasma in den Zellkern gelangt und dort die Expression von per und tim hemmt. Zu Beginn der Lichtphase findet dadurch keine Transkription dieser Gene mehr statt. Im Tagesverlauf werden diese beiden Proteine wieder abgebaut, so daß die Expression von per und tim wieder beginnt, um einen neuen Zyklus einzuleiten. Bei Maus und Mensch wurde ein Gen isoliert, das starke Homologie zum per-Gen von Drosophila aufweist. PER, TIM u. a. beeinflussen als Transkriptionsfaktoren in Rückkopplungsschleifen ihre eigene Produktion über Schwellenwerte. Für die Interaktion der Transkriptionsfaktoren spielen Phosphorylierungs-/Dephosphorylierungsreaktionen eine entscheidende Rolle – und somit eine Kopplung an den Energiestoffwechsel. (Modell des Zusammenspiels der sich gegenseitig steuernden Regelkreise und ihrer Anbindung an äußere Zeitgeber wie Licht, Temperatur usw.: vgl. Abb. 7). Die Wechselwirkungen der inzwischen zahlreich gefundenen "Uhrenproteine" (Transkriptionsfaktoren) können in verschiedenen Organismen stark variieren. Bei Säugern konnte z. B. gezeigt werden, daß Cryptochrom, ein lichtempfindliches Protein, zusammen mit PER die Produktion der Proteine Clock (clock) und Bma1 hemmt. (Bei Pflanzen und Fliegen sind Cryptochrome Photorezeptoren, mit denen die circadiane Rhythmik durch Licht-Dunkel-Wechsel frequenzsynchronisiert wird.) Wesentlich für die Regelkreise der rhythmischen Proteinsynthese bei Eukaryoten sind Transportvorgänge zwischen Kern und Cytoplasma, die die circadian-rhythmische Verfügbarkeit von Transkriptionsfaktoren steuern. Bei Pflanzen spielt Phytochrom als Photorezeptor hierbei eine entscheidende Rolle. Die Feedback-Regelung oszillierender Transkriptionsraten scheint ein universelles Prinzip (circadian-)rhythmischer Proteinsynthese zu sein. Die Regelung von Entwicklung und Verhalten erfordert die Integration einer Vielzahl von endogenen (z. B. Ca2+, pH-Wert) und exogenen (Licht, Temperatur, biotische und abiotische Stressoren) Signalen, die das komplexe Muster der Genexpression regeln. Die Anpassung der biologischen Systeme erfordert das kombinatorische Zusammenspiel einer begrenzten Zahl von Transkriptionsfaktoren als Grundlage für ein komplexes Spektrum der Genexpression. – Störungen der zeitlichen Organisation von Entwicklungsabläufen sind vermutlich bei der Umschaltung vom normalen Wachstum zum Tumorwachstum beteiligt. Aufwachrhythmus, Biorhythmik, Biorhythmologie, Bünning (E.), Chaos, Chronopharmakologie, clock, frequency, Nachtpause, period, soziale Zeitgeber, Vogelzug; Chronobiologie I , Chronobiologie II .
Lit.: Bünning, E.: Die physiologische Uhr. Circadiane Rhythmik und Biochronometrie. Berlin, Heidelberg, New York 31977. Hildebrandt, G., Moser, M., Lehofer, M.: Chronobiologie und Chronomedizin. Biologische Rhythmen – Medizinische Konsequenzen. Stuttgart 1998. Johnsson, A.: Zur Biophysik biologischer Oszillatoren. In: Hoppe, W., Lohmann, W., Markl, H., Ziegler, H. (Hg.): Biophysik. Berlin 21982. Lemmer, B.: Chronopharmakologie. Tagesrhythmen und Arzneimittelwirkung. Stuttgart 21984. Meier-Koll, A.: Chronobiologie. Zeitstrukturen des Lebens. München 1995. Moore-Ede, M.C., Sulzmann, F.M., Fuller, Ch. A.: The Clocks That Time Us. Physiology of the Circadian Timing System. Cambridge/Mass., London 1982. Saunders, D.S.: Insect Clocks. Pergamon International Library of Science, Technology, Engineering and Social Studies. Pergamon Press Oxford, New York, Toronto, Sydney, Paris, Frankfurt 1982. Winfree, A.T.: The Geometry of Biological Time. Biomathematics Volume 8. New York, Heidelberg, Berlin 1980. Winfree, A.T.: Biologische Uhren. Zeitstrukturen des Lebendigen. Heidelberg 1988.
| |
| Abb. 7: Flußdiagramm zur Veranschaulichung von Regelkreisen, die der circadian-rhythmischen Steuerung von Stoffwechsel und Verhalten auf zellulärem Niveau zugrunde liegen. Im Basis-Regelkreis steuert eine circadiane Rhythmik der Energietransduktion die circadian-rhythmischen Empfindlichkeitsänderungen von membrangebundenen Photorezeptoren, während im Gegenzug membrangebundene Photorezeptoren oder nachgeschaltete Signalmoleküle über Konformationsänderungen der Membranen die circadiane Rhythmik der Energietransduktion mit dem Licht-Dunkel-Wechsel synchronisieren. Die Koordinierung der Stoffwechselnetze erfolgt über circadian-rhythmische Änderungen im Phosphorylierungs- und Redoxpotential sowie der Hydrophobizität. Eine circadiane Rhythmik der Proteinsynthese erfolgt durch Autoregulation der Verfügbarkeit von Transkriptionsfaktoren wie PER und TIM und deren Phosphorylierung im Cytoplasma zum transportkompetenten Heterodimer zur Transkriptionskontrolle im Zellkern. |



Schreiben Sie uns!