Lexikon der Biologie: Selektine
Selektine [von *selekt- ], Selectine, Zucker erkennende und bindende Proteine auf der Oberfläche von Blutzellen und Epithelzellen ( vgl. Abb. ), die u.a. die spezifische Adhäsion von neutrophilen Granulocyten und anderen Leukocyten an das Endothel der Blutgefäße vermitteln. Ausgehend von der Röntgenstrukturanalyse eines anderen Zucker-bindenden Proteins, des Mannose-bindenden Proteins, bei dem gezeigt wurde, daß die Kontaktfläche zwischen dem Lectin und dem Zucker relativ flach ausgeprägt ist, wird für die Selektine eine ähnliche Struktur angenommen. Die Selektine binden an eine einfache Zuckerdeterminante (sialyl Lewis x, sLex genannt). Patienten mit einem Defekt in ihrem Zuckerstoffwechsel, die keine sLex-Determinanten auf ihren Zellen exprimieren, leiden an sog. rekurrenten (wiederkehrenden) bakteriellen Infektionen, sind geistig zurückgeblieben und von kleinerem Wuchs. Zellen dieser Patienten binden nicht an E-Selektine (s.u.). – Selektine bestehen aus 3 typischen Domänen: einer N-terminalen, extrazellulären Domäne mit 117–120 Aminosäuren, die für die Ca2+-abhängige Bindung von Zuckerresten zuständig ist und Homologien zu tierischen C-Typ-Lectinen aufweist, einer Domäne mit 34–40 Aminosäuren, die Ähnlichkeit mit dem epidermal growth factor (EGF) zeigt, sowie 2–9 je 62 Aminosäuren umfassenden Consensus-Sequenzen, die mit Proteinen, welche das Komplement-System (Komplement) regulieren, verwandt sind. Es werden 3 Formen von Selektinen unterschieden: L-, P- und E-Selektine. L-Selektine (auch als Mel-14, CD62L oder LAM-1 bezeichnet), sog. homing-Rezeptoren, werden auf allen zirkulierenden Leukocyten exprimiert, mit Ausnahme einiger Gedächtniszellen. Nach Aktivierung der Zellen (Lymphocyten-Aktivierung) werden sie durch proteolytischen Verdau von der Zelloberfläche abgegeben. Die induzierte Bindung kommt vermutlich durch die Induktion der Expression des Liganden von L-Selektinen zustande. P-Selektine (auch als PADGEM, CD62P oder GMP-140 bezeichnet) werden in den sog. Weibel-Palade-Körperchen von Endothelzellen und in den α-Granula von Thrombocyten gespeichert. In Antwort auf Mediatoren entzündlicher Reaktionen wie Thrombin oder Histamin werden sie rasch zur Zelloberfläche transportiert, wo sie an neutrophile Granulocyten und Monocyten binden. Auch eine Induktion der mRNA (messenger-RNA) für P-Selektine konnte gezeigt werden. Nach der Ankunft an der Zelloberfläche werden P-Selektine durch Endocytose wieder aufgenommen. E-Selektine (auch als CD62E oder ELAM-1 bezeichnet) werden auf den Endothelzellen der Blutgefäße induziert (durch Cytokine wie Interleukin 1 [Interleukine], Lipopolysaccharid oder Tumor-Nekrosis-Faktor). Dabei wird die RNA neu synthetisiert. Auch E-Selektine werden durch Endocytose wieder aufgenommen und in Lysosomen degradiert. Von allen 3 Mitgliedern der Selektin-Familie wurden lösliche Rezeptorformen nachgewiesen. – Selektine vermitteln relativ schwache, heterotype Zell-Zell-Adhäsion (heterotype Adhäsion), vor allem die reversible Bindung von Blutzellen an die Epithelien von Blutgefäßen. Durch Knüpfen und Auflösen der Bindung zwischen Selektinen und ihren Bindungspartnern kommt es zu einer Art „Rollen“ der Zellen in Richtung des Blutstroms entlang der Gefäßwände. Diese labile Anheftung ist der erste Schritt bei der Blutzellenadhäsion. Bei allen Selektinen wird die Expression des Proteins auf der Zelloberfläche nach kurzer Zeit beendet, um das nächste Stadium während der Blutzellenadhäsion einzuleiten. Dabei erfolgt eine festere Adhäsion, bei der Integrine wie z.B. LFA-1 (lymphocyte function-associated molecule-1, auch als CD11a/CD18 bekannt), die durch den PAF (platelet activating factor) induziert werden, die Hauptrolle spielen. Darüber hinaus sind Faktoren wie CR3 (complement-receptor 3, auch MAC1 oder CD11b/CD18; Komplement-Rezeptoren) und VLA-4 (very late antigen 4 oder CD49d/CD29) sowie Mitglieder der Immunglobulin-Superfamilie (CAMs), wie ICAM-1, ICAM-2 (intercellular adhesion molecule) und V-CAM-1 (vascular cell adhesion molecule), an der Adhäsion der Zellen (Zelladhäsion) beteiligt. Einige der an verschiedenen Stadien dieser Interaktionen beteiligten Moleküle finden sich an cytoplasmatischen Fortsätzen der Zelle konzentriert. Die Kohlenhydratstrukturen, die von L- und P-Selektinen erkannt werden, sind über O-Atome an spezifische Mucin-ähnliche Moleküle gebunden (O-linked). Mucine sind Serin- und Threonin-reiche Proteine, die stark O-glykosyliert sind und eine gestreckte Struktur haben ( vgl. Abb. ). Das Zuckermuster der Mucine scheint bei verschiedenen Zellen unterschiedlich zu sein. PSGL-1 (P-selectin glycoprotein ligand 1) wirkt z.B. nur dann als Ligand, wenn die Zellen auch eine α-3/4-Fucosyltransferase-Aktivität besitzen. Adhäsine, CD-Marker.
U.T./M.B.
Selektine
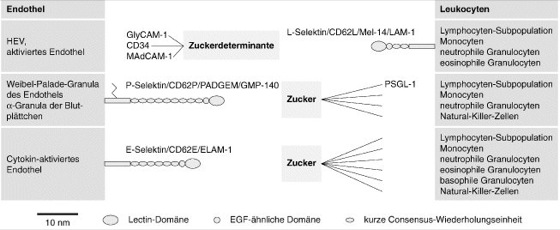
Selektine und ihre Liganden:
Die Abb. zeigt Liganden des P-, E- und L-Selektins auf Subpopulationen von Lymphocyten und ihre Interaktion mit dem entsprechenden Selektin. Liganden der Selektine sind Zuckerdeterminanten, die sich auf verschiedenen Geweben finden. Über diese Zuckerdeterminanten ist noch wenig bekannt. Nur in wenigen Fällen (z.B. bei GlyCAM-1) ist das entsprechende Molekül gut charakterisiert. Die Selektine sind zusammen mit ihren alternativen Bezeichnungen angegeben (LAM: lymphocyte adhesion molecule, PADGEM: platelet activation dependent granule external membrane protein, GMP: granule membrane protein, ELAM: endothelial leukocyte adhesion molecule). Von den Mucinen, an welche die Selektine binden, sind noch nicht alle isoliert.
GlyCAM-1, glycosylation-dependant cell adhesion molecule 1: ein Mucin, das in membrangebundener und sekretierter Form vorkommt; in den Hoch-Endothel-Venulen (HEV) der Lymphknoten exprimiert;
CD34: ein weit verbreitetes Mucin der Zelloberfläche;
MAdCAM-1, mucosal addressin cell adhesion molecule 1: ein Protein, das 3 Immunglobulindomänen und 1 Mucin-ähnliche Region zwischen der 2. und 3. Immunglobulindomäne aufweist; zunächst als Ligand des Integrins α4/β7 identifiziert, mit dem es über die Immunglobulin-Domänen interagiert;
PSGL-1: P-selectin glycoprotein ligand 1: ein Mucin-ähnliches Molekül.
Schreiben Sie uns!