Kompaktlexikon der Biologie: Actin
Actin, Aktin, in allen eukaryotischen Zellen vorkommendes Strukturprotein. Eigentlich sind die Actine eine ganze Familie überaus einheitlicher Proteine, die entsprechend ihrer Funktionen in der Zelle in zwei Gruppen unterteilt werden: die am Aufbau der Muskulatur (Muskel) beteiligten α-Actine und die cytoplasmatischen β-Actine und γ-Actine. In den meisten Organismen und Zelltypen werden mehrere dieser Actine gleichzeitig ausgebildet, codiert durch eine ganze Familie von Actingenen (Multigenfamilie), die durch Genduplikation auseinander hervorgegangen sind.
Das Actinmolekül wird als monomeres G-Actin (globuläres A.) synthetisiert und besteht aus einer einzigen Polypeptidkette mit einer relativen Molekülmasse von 40000-45000 (je nach Art und Actin). Die G-Actin-Monomere zeigen eine deutliche Polarität: An ihrer Plus-Seite können sie mit hoher Affinität Ca2+, ATP oder ADP binden. Bei Anwesenheit von K+ oder Mg2+-Ionen polymerisieren die Monomere spontan zu perlschnurartigen Ketten aus F-Actin (filamentäres Actin). Dabei wird pro angefügtem G-Actin ein Molekül ATP zu ADP und Phosphat (Pi) hydrolisiert. Das entstehende ADP bleibt an die Kette gebunden. I.d.R. winden sich dann zwei derartige Ketten zu einem Doppelfilament (Actinfilament ( vgl. Abb. )) umeinander, wobei der Grad der Polymerisation unter physiologischen Bedingungen durch eine Reihe Actin-bindender Proteine gesteuert wird.
In pflanzlichen wie tierischen Zellen sind Actine, gewöhnlich im Zusammenwirken mit Myosinen (Myosin) entscheidend an der Erzeugung intrazellulärer Bewegungsvorgänge beteiligt, wie Plasmaströmung und amöboider Bewegung. Zudem spielen sie bei der Bildung von Kontaktstrukturen zwischen Zellen und bei der Adhäsion an Substrate eine wichtige Rolle. Im Muskel bilden sie zusammen mit Myosinfilamenten den Motor der Muskelkontraktion. In Pflanzen wird darüber hinaus z.B. die Durchlässigkeit der Plasmodesmen über A. gesteuert, Actine sind für die Festlegung der Zellteilungsachse wichtig und spielen auch bei der auxinabhängigen Zellstreckung eine Rolle. Einige Pflanzenviren benutzen das Actingerüst der Wirtszelle, um sich dadurch über die Plasmodesmen von Zelle zu Zelle fortzubewegen und sich so in der Pflanze auszubreiten.
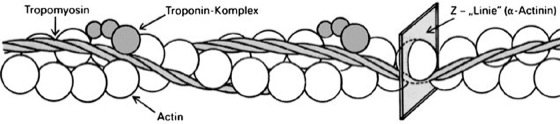
Actin: Ausschnitt eines Actinfilaments aus dem Sarkomer des quergestreiften Muskels. Zwei „Perlenketten“ aus G-Actinen winden sich umeinander. In die Rinne zwischen beiden Ketten schmiegen sich kürzere Doppelhelices des Tropomyosins und Troponin-Komplexe als Regel- bzw. Sperrproteine. Die Actinfilamente haben über die Z-Linie hinaus Kontakt mit den Actinfilamenten der benachbarten Sarkomerhälfte
Schreiben Sie uns!