Kompaktlexikon der Biologie: Prionen
Prionen, von engl. proteinaceous infectious particles, Bez. für die proteinartigen infektiösen Partikel, die als nicht eindeutig charakterisierte Erreger von übertragbaren spongiformen Encephalopathien bei Mensch und Tieren vermutet werden, zu denen die Bovine Spongiforme Encephalopathie (BSE), die Creutzfeldt-Jacob-Erkrankung, Kuru und die Scrapie gehören. Die Prionenhypothese postuliert ein einziges Proteinmolekül, das sowohl für erbliche als auch für spontane Formen der gleichen Krankheit verantwortlich sein soll. Als krankheitsverursachende Komponente fungiert eine anormale Isoform PrPSC eines natürlichen zellulären Proteins PrPC, das in allen Säugern und Vögeln vorkommt ( vgl. Abb. ). Es handelt sich um ein hydrophobes Glykoprotein, das auf der Zellaußenseite verankert ist. Funktionell ist es möglicherweise an Signalprozessen sowie an der Zelladhäsion beteiligt. Die Bildung von PrPSC ist ein im Anschluss an die Translation stattfindender Prozess, der nur mit einer Konformationsänderung im PrPC verbunden ist. Im Unterschied zu PrPC ist PrPSC resistent gegen Proteolyse, sodass die für die spongiformen Encephalopathien typischen Degenerationserscheinungen im Gehirn auf eine Tendenz des PrPSC zur Stäbchen- und Plaquebildung zurückgeführt werden könnten. Die hohe Replikationsfähigkeit wird dadurch erklärt, dass jeweils ein PrPSC mit einem zellulären PrPC dimerisiert, das danach in PrPSC umgewandelt wird. Das auslösende PrPSC könnte durch eine zufällige Konformationsänderung, durch Mutation des PrP-Gens oder als Folge von Proteininfektionen gebildet werden. Der gegenwärtige Kenntnisstand lässt die Aussage zu, dass PrPSC entweder tatsächlich den pathogenen Prozess initiiert, oder eine Akkumulation dieser pathogenen Vorgänge im Infektionszentrum des Gewebes bewirkt.
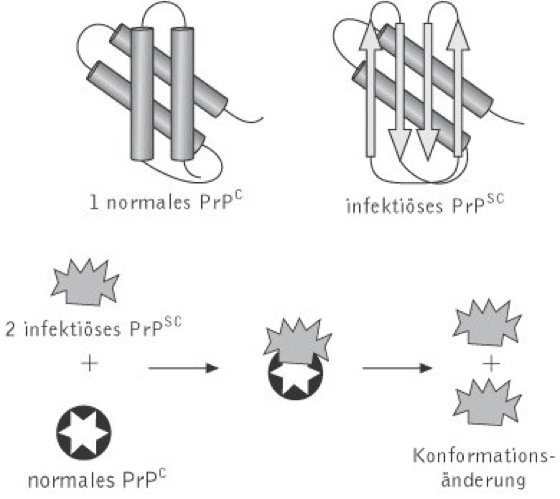
Prionen: 1 Während das normale Prion-Protein (PrPC) vorwiegend aus α-Helices aufgebaut ist, sind in dem infektiösen Prion (PrPSC) eine oder zwei dieser α-Helices in vier antiparallele β-Faltblätter umgelagert. 2 Aus dem Gehirn an BSE erkrankter Schafe wurde Scrapie-PrPSC isoliert. Nach augenblicklichem Kenntnisstand lagert sich Scrapie-PrPSC an normales PrPC an und induziert damit die irreversible Konformationsänderung
Schreiben Sie uns!