Nobelpreise 2010: Vater von vier Millionen
Der Nobelpreisträger Robert Edwards hat über Jahrzehnte versucht, menschliche Eizellen außerhalb des Körpers zu befruchten. Heute helfen seine Ergebnisse unfruchtbaren Paaren weltweit.
© 2010 The Nobel Committee for Physiology or Medicine / Mattias Karlén (Ausschnitt)
© Sheikh Hamdan Bin Rashid Al Maktoum Award for Medical Sciences (Ausschnitt)
Der Medizin-Nobelpreisträger 2010 | Robert G. Edwards, ein 1925 geborener Engländer und Emeritus der University of Cambridge, erhält den Nobelpreis für Medizin oder Physiologie 2010 für seine Entwicklung der In-vitro-Fertilisation.
Nichts Neues für ein Fachgebiet, das schon vor 30 Jahren in der Öffentlichkeit heiß diskutiert wurde. Damals, am 25. Juli 1978, hatte die künstliche Befruchtung ein Gesicht bekommen: Ein Mädchen namens Louise Brown war per Kaiserschnitt auf die Welt gekommen, das erste "im Reagenzglas gezeugte" Baby. Den glücklichen Eltern war zuvor neun Jahre lang ihr Kinderwunsch unerfüllt geblieben. Nun hatten sie eine gesunde Tochter, die sie ohne Edwards' Vision und seine Hartnäckigkeit nie bekommen hätten. Beides – Vision und zielstrebige Umsetzung einer medizinischen Idee, die das Leid vieler Menschen lindern kann – machen Edwards zu einem verdienten alleinigen Preisträger, findet das Nobelkomitee.
Verlustreicher Weg
© 2010 The Nobel Committee for Physiology or Medicine / Mattias Karlén (Ausschnitt)
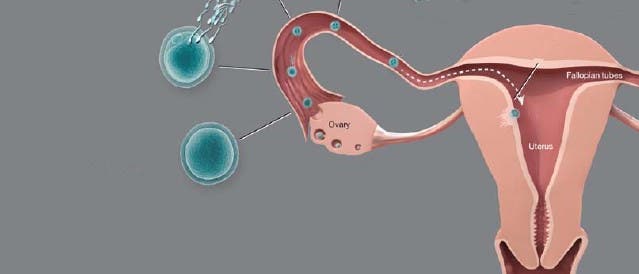
Befruchtung einer weiblichen Eizelle | Die weiblichen Gameten sind in den Ovarien in separaten Follikeln gespeichert: Jeder Follikel enthält eine Keimzelle, die von einer oder mehreren Schichten granuloser Zellen umgeben ist. Wie andere Säugetiere werden auch Menschen mit einem vordefinierten Satz primordialer Oozyten geboren, die in einer bestimmten Phase der Reifeteilung, dem Diktyotän der Meiose I, arretiert sind. Nach der Pubertät sorgen hormonelle Signale während des Menstruationszyklus dafür, dass Monat für Monat einzelne primäre und sekundäre Follikel heranreifen. Schließlich wird eine Kaskade von Vorgängen eingeleitet, die das Wachstum der Oozyte und die Wiederaufnahme der Meiose anstößt. Die Reifeteilung läuft bis zur Metaphase der Meiose II ab und stoppt dann erneut – ein Paar von Chromosomen wird zuvor als Polkörperchen entsorgt. Nun folgt der Eisprung: Der Follikel reißt, und das Ei geht auf seine Reise durch den Eileiter. Nun muss ein einzelnes Spermium in die Eizelle eindringen, um sie zu befruchten.
Die erste Hürde stellten dabei schon die zu befruchtenden Eizellen: In den kritischen, befruchtungsfähigen Zustand der Reifeteilung, dem Metaphasestadium der Meiose II, gelangen die – damals stets chirurgisch aus dem Ovar von unfruchtbaren Frauen herausoperierten – Zellen überhaupt erst, nachdem sie einem über 24 Stunden andauernden Reifeprozess ausgesetzt werden. Dann – und nur in einem geeigneten Puffergemisch – können voraktivierte Spermien sie befruchten, ergaben die Forschungsbemühungen schließlich.
© 2010 The Nobel Committee for Physiology or Medicine / Mattias Karlén (Ausschnitt)
Die In-vitro-Fertilisationstechnik nach Edwards | Bei der IVF müssen zunächst Oozyten gewonnen werden, die sich in der kritischen, befruchtungsfähigen Metaphase der Meiose II befinden – früher erfolgte dies mit Hilfe der Laparoskopie. Die Oozyten werden dann in einer Petrischale mit Puffersubstanzen und Spermien gemischt – das Medium aktiviert die Samenzellen, eine Grundvoraussetzung für die erfolgreiche Befruchtung. Ein eindringendes Spermium löst dann die Arretierung der Reifeteilung der Eizelle. Einer der beiden haploiden Chromosomensätze der Eizelle verschmilzt nun mit dem haploiden Gegenpart des Spermiums, und schließlich beginnt sich die befruchtete, nun diploide Eizelle zu teilen. Der junge Embryo wird dann im Achtzellstadium mit einer dünnen Nadel in den Uterus der Mutter übertragen – etwa zweieinhalb Tage nach dem Beginn der Befruchtung. Hier wird sich der Embryo dann weiter bis zum Blastulastadium entwickeln und schließlich in die Gebärmutterschleimhaut einnisten.
Frühe Fehlschläge
Damit begann allerdings ein dunkles Kapitel in der Geschichte der künstlichen Befruchtung, denn mehr als einhundert künstlich herbeigeführte Schwangerschaften dauerten nur allzu kurz – offenbar verhinderte die Hormonbehandlung, der sich die Frauen unterziehen mussten, um zu Eizellenspenderinnen zu werden, die erfolgreiche Einnistung und Entwicklung der Embryos.
Schließlich lernten Steptoe und Edwards die natürlichen Schwankungen der weiblichen Hormone während des Zyklus zu interpretieren, um den optimalen Zeitpunkt zur Gewinnung der Oozyte nach dem Eisprung abzupassen. Die Implantation gelang mit so isolierten und befruchteten Eizellen viel besser – und führte dann endlich auch zu der glücklich endenden Schwangerschaft 1978 [1]. Louise Brown ist heute selbst Mutter und gesund – wie viele andere ehemalige "Retortenbabys". Die Zeit habe gezeigt, dass aus künstlicher Befruchtung entstandene Kinder ihr Leben gesund leben können; dass die Technik also tatsächlich viel Leid lindern konnte – und damit sei nun auch überfällig, den Urheber zu ehren, fasst das Nobelpreiskomitee zusammen.
Fortschritte und Fragezeichen
Seit 1978 ist die In-vitro-Fertilisationstechnik in vieler Hinsicht weiterentwickelt worden; mittlerweile ist sie in den hoch technisierten Industrieländern eine etablierte Methode zur Behandlung von Unfruchtbarkeit. Männer mit unbeweglichen Spermien profitieren heute von einer Technik, bei der man ihre Samenzellen in Oozyten injiziert. Statt der Laparoskopie setzt man heute ultraschallgesteuerte Oozytenentnahmetechniken ein, und längst kann man Oozyten aus hormonbehandelten Frauen auch schockgefrieren, lagern und später einsetzen.
© Edwards, R.G. et al.: Fertilization and Cleavage in vitro of Preovulator Human Oocytes. In: Nature 227, S. 1307–1309, 1970, fig. 2 (Ausschnitt)
Das Achtzellstadium: Ein sehr junger Mensch | Das Achtzellstadium einer künstlich befruchteten Eizelle. In diesem Stadium wird der Zellhaufen aus der Kulturschale in die Mutter überführt, damit es sich hier entwickelt. Die Abbildung stammt aus der Originalpublikation des Nobelpreisträgers aus dem Jahr 1970.
Immerhin hatte sich der Forscher tatsächlich bald und später immer wieder einer lauter werdenden Debatte gestellt. Das unterscheidet ihn übrigens vom aktuellen Nobelpreiskomitee. Das Gremium beantwortete Fragen nach ethischen Implikationen der preiswürdigen Arbeit stereotyp: Die Debatte sei in zurückliegenden Jahrzehnten geführt und abgeschlossen worden, nachdem sich der Segen der Technik gezeigt habe. Und: Man sei als Nobelpreiskomitee nur aufgerufen, den wissenschaftlichen Gehalt einer Forscherkarriere zu bewerten – und der rechtfertige unbedingt eine Auszeichnung.
Viel lieber möchte das Komitee in den Vordergrund gestellt sehen, dass hier statt reiner Grundlagenforschung endlich wieder einmal öffentlichkeitsrelevante medizinische Forschung mit hohem Anwendungsbezug geehrt werde. Immerhin vier Millionen Leben seinen womöglich nur durch die In-vitro-Fertilisationstechnik geboren worden, rechneten die Schweden aus. Viele Paare geben dem übrigens lautstark Recht, wie die Gratulationsseite des Karolinska-Instituts beweist. Viele Stimmen machen hier aber auch deutlich, dass die Debatte über die Grenzen der medizinisch-menschlichen Kontrolle des Lebens alles andere als abgeschlossen ist – oder jemals sein sollte.

Schreiben Sie uns!
Beitrag schreiben