Lexikon der Biochemie: Gallenfarbstoffe
Gallenfarbstoffe, lineare Tetrapyrrole, die durch den Abbau von Porphyrinen, insbesondere des Häms, gebildet werden (Abb. 1). Die α-Methinbrücke des Protohäms zwischen den Ringen A und B wird oxidativ gespalten mit Hilfe mikrosomaler Hydroxylasen [mikrosomale Häm-Oxygenase (Dezyklisierung), EC 1.14.99.3, die unbedingt die NADPH-Ferrihämoprotein-Reduktase, EC 1.6.2.4, benötigt], wobei Kohlenmonoxid und Biliverdin IX entstehen. Das Eisen wird zu Fe(II) reduziert und dem Eisenpool des Körpers zugeführt oder in Form von Hämosiderin und Ferritin gespeichert. Biliverdin wird zu Bilirubin reduziert und in einem Komplex mit Serumalbumin zur Leber transportiert.
Bilirubin wird vor allem durch den Abbau von Hämoglobin reifer Erythrocyten im reticuloendothelialen System (Milz), im Knochenmark und in der Leber gebildet. Besonders bei perniziöser Anämie entsteht ein Teil des Bilirubins auch beim Abbau von Myoglobin und Cytochrom. Bei hämolytischer Gelbsucht kommt es in großen Mengen im Serum und im Gewebe vor und befindet sich bei Kindern im Urin und in den Fäzes. In freier Form (d. h. nicht an Serumalbumin gebunden) ist es hoch toxisch, besonders bei Neugeborenen, wo es die Blut-Hirn-Schranke schneller überwindet als bei Erwachsenen. Es wirkt als Atmungsentkoppler. Plasmabilirubin dissoziiert in der Leber von Albumin ab und wird im Cytoplasma der Leberzellen konzentriert. Hierauf wird Bilirubin mit zwei Glucuronsäureresten konjugiert (Abb. 2, katalysiert durch die Glucuronosyltransferasen EC 2.4.1.76 und EC 2.4.1.77, die hauptsächlich im glatten endoplasmatischen Reticulum der Leberzellen lokalisiert sind). Das konjugierte Bilirubin wird in die Galle ausgeschieden, wo es wahrscheinlich an Lecithin oder Gallenproteine gebunden ist. Im Dickdarm wird der größte Teil des Konjugats hydrolysiert und das dabei entstehende freie Bilirubin durch Darmbakterien zu d-Urobilinogen, Stercobilinogen und meso-Bilirubinogen reduziert. Diese farblosen Verbindungen werden durch Sauerstoff zu Stercobilin und Urobilin oxidiert, die die braune Farbe der Fäzes verursachen.
Biliverdin kommt in der Galle einiger Tiere, in der Plazenta einiger Säugetiere (Uteroverdin) und in der Eischale vieler Vögel (Oocyan) vor. Man findet es auch im Mekonium von Föten und Neugeborenen und in postmortaler Galle.
Durch die Reduktion der zwei Vinylsubstituenten des Bilirubins zu Ethylgruppen entsteht meso-Bilirubin. Eine weitere Reduktion der Methinbrücken führt zu meso-Bilirubinogen, das sich in der Gallenflüssigkeit, im Urin und in den Fäzes findet und bei pathologischem Leberzustand in erhöhter Menge vorliegt. Spuren des Urobilinogens werden vom Pfortaderblut absorbiert, zur Leber zurückgebracht und mit der Gallenflüssigkeit ausgeschieden. Ein Teil des Urobilinogens gelangt jedoch in das Blutkreislaufsystem und tritt eventuell im Urin auf (bis zu 4mg/24h). Bei Vorliegen von Okklusionsikterus befindet sich im Urin und in den Fäzes praktisch kein Urobilinogen. Bei hämolytischem Zustand ist die Konzentration an Urobilinogen im Urin und in den Fäzes erhöht. Stercobilinogen ist das Hauptausscheidungsprodukt des Hämoglobins bei den meisten Vertebraten und sein Oxidationsprodukt, Stercobilin (l-Uroabilin), ist Bestandteil des normalen Urins und der normalen Fäzes. i-Urobilin (Urobilin IXα; das Oxidationsprodukt von meso-Bilirubinogen) und d-Urobilin (das Oxidationsprodukt von d-Urobilinogen) finden sich in normalem Urin und in den normalen Fäzes.
Lineare Tetrapyrrole können Metallkomplexe bilden, in denen das Metallion an alle vier Stickstoffatome in einer nahezu planaren Ringstruktur gebunden ist. Dies ist möglich, weil der Pyrrolring sowohl in der Lactim- als auch in der Lactamform vorliegen kann. Der in dem Metallkomplex gebildete Ring wird vermutlich durch Wasserstoffbrückenbindungen stabilisiert, wie z. B. beim Verdohäm und Biliverdinhäm.
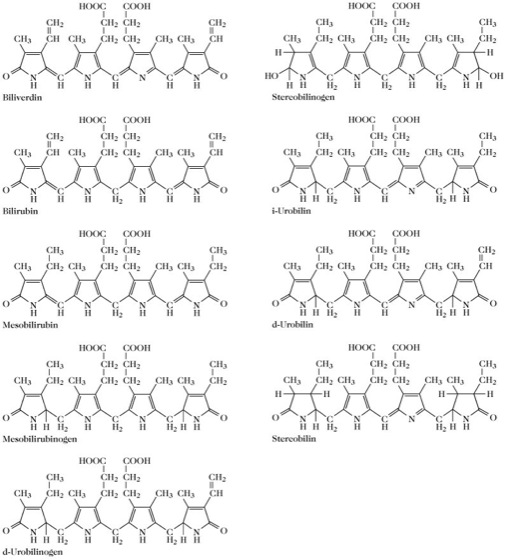
Abb. 1. Gallenfarbstoffe. Einige Gallenfarbstoffe und verwandte Verbindungen.
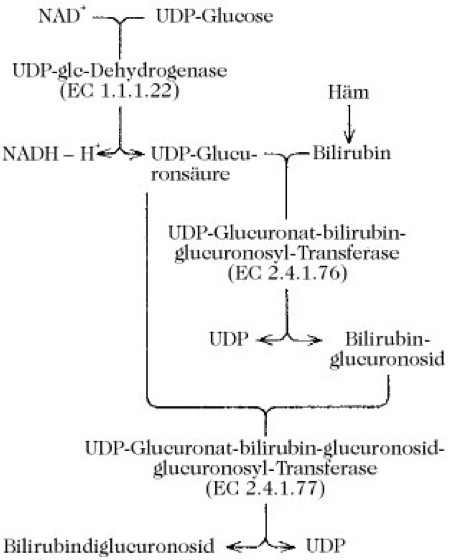
Abb. 2. Gallenfarbstoffe. Biosynthese des Bilirubindiglucuronosids.
Schreiben Sie uns!