Lexikon der Biochemie: Attenuation
Attenuation, ein in Bakterienzellen vorkommender Regulationsmechanismus. Während die Enzymrepression der Zelle erlaubt, auf extreme Metabolitenkonzentrationen zu reagieren, ermöglicht die A. vermutlich die Feinabstimmung als Reaktion auf kleine Veränderungen der Metabolitenkonzentrationen. Die A. ist nachweislich wirksam bei der Synthese von Tryptophan, Phenylalanin, Histidin, Leucin, Threonin, Isoleucin und Valin bei E. coli und bei der Synthese von Histidin, Leucin und Tryptophan bei Salmonella typhimurium.
Vermutlich sind bei allen Bakterien in jedem Operon der Aminosäurebiosynthese Attenuationsstellen vorhanden.
Das erste Strukturgen des Operons ist von der Promotor-Operator-Region durch ein DNA-Stück getrennt, der sog. Leitsequenz (engl. leader sequence). Die Transcription des Operons verläuft fortlaufend über diese Leitsequenz und die Strukturgene. Im Fall des trp-Operons von E. coli z.B. wird eine einzige, fortlaufende trp-mRNA aus 7.000 Nucleotiden gebildet, die am 5'-Ende die Leitsequenz (162 Nucleotide) enthält, gefolgt von der mRNA-Sequenz für die Enzyme des Biosynthesewegs. Das Transcript wird nur komplett gebildet, wenn Tryptophan relativ knapp ist. Ist der Tryptophanspiegel hoch, wird nur ein Teil der Leitsequenz transcribiert, dann kommt es zur Termination. Dadurch wird ein kleines Transcript aus 140 Nucleotiden produziert. Der regulierende Faktor ist nicht das Tryptophan selbst, sondern die Tryptophan-Aminoacyl-tRNA, deren Konzentration die Verfügbarkeit von Tryptophan wiedergibt. Ein Teil der Leitsequenz-RNA wird in ein Peptid aus 14 Aminosäureresten translatiert, von denen zwei Tryptophan sind. Die Codons dieser zwei Trp-Reste besetzen in der Leitsequenz-RNA strategische Positionen (Abb. 1 und Abb. 2). Die Analyse der Leitsequenz-RNA zeigt, dass mehr als eine Sekundärsequenz möglich ist. Welche Sekundärstruktur tatsächlich vorhanden ist, wird durch das Fortschreiten der Ribosomen an der RNA bestimmt. Wenn Tryptophan-Aminoacyl-tRNA im Überfluss vorhanden ist (ebenso wie alle anderen Aminoacyl-tRNA-Spezies, die gebraucht werden), dann verläuft die Translation glatt und das Ribosom erreicht das Stopp-Codon. An diesem Punkt überlappt das Ribosom mit zwei Regionen (Region A und B in Abb. 1 und Abb. 2) der RNA, die die potenzielle Fähigkeit besitzen, eine Sekundärstruktur ausbilden zu können. Die einzige Sekundärstruktur, die dann möglich ist, ist eine durch die Regionen C und D gebildete Haarnadelstruktur, die als Terminationssignal für die Transcription dient. Wenn die Tryptophan-Aminoacyl-tRNA knapp ist, kommt das Ribosom früher, an den Trp-Codons, zum Stillstand. Dann ist nur die Region A bedeckt, es bildet sich eine Sekundärstruktur aus, die keine Inhibitorfunktion besitzt, und die Transcription der Strukturgene läuft ab. Wird das koordinierte Fortschreiten von Transcription und Translation berücksichtigt, wie es in der Abb. 2 dargestellt ist, so lässt sich der Mechanismus noch besser verstehen. Es ist ersichtlich, dass die A. eine abgestufte Reaktion auf leichte Konzentrationsveränderungen der regulierenden Aminosäure darstellt. Diese Steuerung funktioniert nicht nach dem "Alles oder Nichts"-Prinzip oder aufgrund eines Schwellenwerts und auch nicht durch Repression oder Rückkopplungsinhibierung, die beide durch einen An/Ausschalt-Mechanismus regulieren. Es ist unwahrscheinlich, dass das Ribosom tatsächlich am trp-Codon vollständig anhält, vielmehr wird es in Abhängigkeit von der relativen Versorgung mit der Aminoacyl-tRNA der regulierenden Aminosäure seine Geschwindigkeit verlangsamen oder pausieren. In Anbetracht der Geschwindigkeit der Transcription und der koordinierten Translation (Inkorporation von 45 Nucleotidresten je Sekunde; ca. 4 Minuten für die Transcription des gesamten trp-Operons; ca. 3 Minuten für den kompletten Abbau des trp-Operon-Transcripts) wird schon eine Verlangsamung des Ribosoms ausreichen, um die Ausbildung einer nichtinhibitorischen Struktur der Leitsequenz-RNA zu begünstigen. Die beiden RNA-Sekundärstrukturen müssen deshalb als zwei thermodynamische Extreme betrachtet werden, die zu einem gewissen Grad im Gleichgewicht stehen.
In allen Attenuationssystemen, die bisher untersucht wurden, ist der Mechanismus analog zu dem hier für die Tryptophansynthese in E. coli beschriebenen, d.h. die Codons für die regulierende Aminosäure sind an strategischen Positionen in der Leitsequenz-RNA angeordnet. Bis zu sieben strategische Codons können vorhanden sein (z.B. Phe- und His-Attenuation in Salmonella). [D.L. Oxender et al. Proc. Natl. Acad. Sci USA 76 (1979) 5.524-5.528; R.M. Gemmill et al. ibid. 4.941-4.945; H.M. Johnston et al. Proc. Natl. Acad. Sci. USA 77 (1980) 508-512; C. Yanofsky u. R. Kolter, Annu. Rev. Genet. 16 (1982) 113-134]
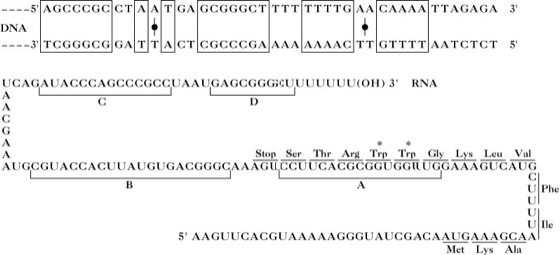
Attenuation. Abb. 1. Attenuatorstelle in der Leitsequenz des Tryptophansyntheseoperons von E. coli und die komplette Sequenz der terminierten Leitsequenz-RNA. Zwei Regionen in der trp-Attenuator-DNA besitzen eine zweizählige Symmetrieachse. A, B, C, D in der RNA entsprechen den markierten Regionen in Abb. 2. Basenpaarung mit resultierender Haarnadelbildung ist möglich zwischen A und B (Freie Bildungsenergie -46,9kJ/mol), B und C (-49kJ/mol) und C und D (-83,7kJ/mol), Codons für das Leitsequenz-Peptid sind ebenfalls abgebildet und die zwei strategischen Trp-Codons sind durch Sterne gekennzeichnet.
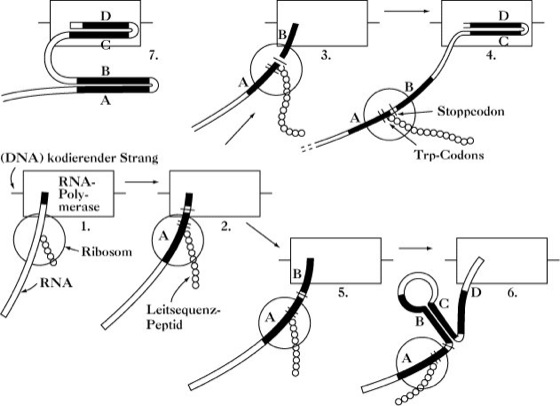
Abb. 2. Attenuation. Schematische Darstellung der Attenuation während der koordinierten Transcription und Translation, basierend auf der Attenuation des Tryptophansyntheseoperons von E. coli.
1. Die RNA-Polymerase hat die Operator-Promotor-Stelle verlassen und hat damit begonnen, die Leitsequenzregion in Richtung des ersten Strukturgens des Operons (Komponente I der Anthranilat-Synthetase) zu transcribieren. Das Startcodon für das Leitsequenz-Peptid ist aufgetaucht, ein Ribosom ist angeheftet, die Translation hat begonnen.
2. Wenn mehr RNA synthetisiert ist, hält die Translation mit der Transcription Schritt. Die Synthese der Region A ist abgeschlossen und die der Region B beginnt gerade. Das Ribosom ist im Begriff, die Trp-Codons der Leitsequenz-Peptid-Message zu translatieren.
3. Tryptophan-Aminoacyl-tRNA ist im Überfluss vorhanden, so dass die Translation fortgesetzt wird und mit der Transcription Schritt hält. Das Ribosom hat gerade das Stopp-Codon erreicht und bedeckt teilweise die Region B, die jetzt vollständig synthetisiert ist.
4. Das Ribosom kann nicht weiter vorrücken, die Transcription läuft aber fort. Erscheint die Region C, kann sie mit der vom Ribosom verdeckten Region B keine Basenpaare bilden. Sobald Region D erscheint, bildet es mit C Basenpaare aus. Die resultierende Sekundärstruktur (CD-Haarnadelstruktur) stellt ein Signal für die Termination der Transcription dar. Die RNA-Polymerase und ihr Transcript verlassen die DNA.
5. Tryptophan-Aminoacyl-tRNA ist knapp, so dass das Ribosom an den Trp-Codons pausiert. Wenn B synthetisiert wird, ist es nicht durch das Ribosom bedeckt. Die Translation hält mit der Transcription nicht Schritt.
6. Wenn sich die Region C von der RNA-Polymerase löst, ist sie in der Lage mit B Basenpaare und eine Haarnadelstruktur zu bilden. Da kein freies C mehr zur Verfügung steht, kann gebildetes D mit C keine Basenpaarbindung eingehen. Das Terminationssignal (CD-Haarnadelstruktur) kann somit nicht entstehen. Die Transcription läuft in Richtung des ersten Strukturgens weiter und das ganze Operon ist transcribiert.
7. Wenn andere Aminoacyl-tRNA-Spezies knapp sind, wird das Ribosom noch nicht einmal A erreicht haben, wenn D aufgetaucht ist. Die thermodynamisch begünstigte Struktur besteht dann in den Haarnadelstrukturen AB und CD. Die Transcription wird durch CD terminiert. Auf diese Weise kann ein Defizit an anderen Aminosäuren die Attenuation der Tryptophansynthese hervorrufen.
Schreiben Sie uns!