Kompaktlexikon der Biologie: Citratzyklus
Citratzyklus, Citronensäure-Zyklus, Krebszyklus, Tricarbonsäure-Zyklus, Zitronensäure-Zyklus, die wichtigste zyklische Reaktionsfolge für den oxidativen Endabbau von Proteinen, Fetten und Kohlenhydraten zu CO2 und H2O. Er wurde 1937 etwa gleichzeitig von H.A. Krebs, G. Martius und F. Knoop (1875-1946) entdeckt. CO2 entsteht im C. durch oxidative Decarboxylierung von α-Ketosäuren. In Verbindung mit der Atmungskette erfolgt der Energieumsatz zur Synthese des energiereichen Adenosintriphosphats (ATP; Adenosinphosphate). Außer für den Energiegewinn ist der C. auch wichtig für die Synthese von neuem zelleigenem Material; er ist also amphibol. Verschiedene wichtige Substanzgruppen stammen von Zwischenprodukten des C. ab und verschiedene Stoffwechselzyklen sind mit dem C. verknüpft. Bei Eukaryoten ist der C. in den Mitochondrien lokalisiert, wo er strukturell und funktionell mit der Atmungskette und dem Fettsäureabbau verbunden ist. Bei Prokaryoten befinden sich die Enzyme des C. im Cytoplasma.
Die biologische Bedeutung des C. liegt in der Oxidation und Zerlegung der Acetylgruppe von Acetyl-Coenzym A in zwei Moleküle CO2, wobei viermal zwei Wasserstoffatome frei werden, die auf NAD+ oder FAD übertragen werden. Die Regeneration dieser Coenzyme erfolgt über die Atmungskette, wobei die Wasserstoffatome zu Wasser oxidiert werden. Die Oxidationen im C. erfolgen durch mehrmalige Wasseranlagerung und anschließende Dehydrierung nach der Summenformel CH3CO – SCoA + 3 H2O → 2 CO2 +8 [H] + HSCoA. Sauerstoff spielt direkt keine Rolle. Initialreaktion des C. ist die Kondensation des Acetyl-CoA mit Oxalacetat, die durch die Citrat-Synthase katalysiert wird. Unter Wasseraufnahme entstehen Citrat und freies Coenzym A. Aus dem Citrat wird über sieben weitere, teilweise komplexe Reaktionsschritte das Oxalacetat regeneriert.
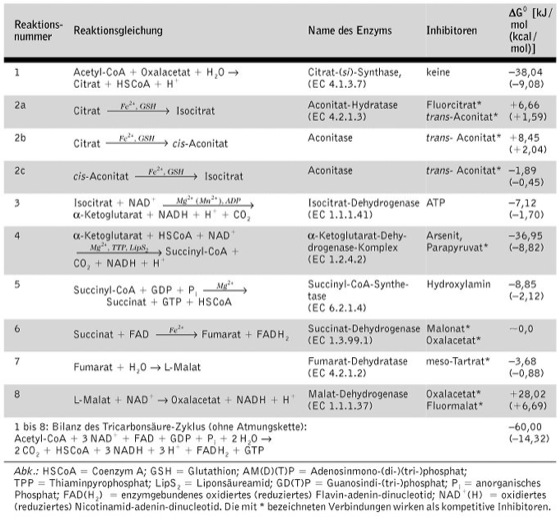
Energiebilanz des C.: Bei der Oxidation von Acetyl-CoA im C. werden insgesamt 901,7 kJ chemische Energie frei, davon 800,29 kJ über die Atmungskette, wobei diese Energie aus zwei NADH und einem FADH2 stammt: NADH + 1/2 O2 + H+ → NAD+ + H2O (ΔG° = -219,4 kJ; FADH2 + 1/2 O2 → FAD + H2O; ΔG° = -151,6 kJ. Ein Teil dieser Energie wird zur Synthese von zwölf Molekülen ATP verwendet, was einer Energieausbeute von etwa 40 % der gesamten freien Energie entspricht: Und zwar entstehen in den Reaktionen 4, 6 und 10 ( vgl. Abb. ) durch NADH-Bildung und dessen anschließende Oxidation in der Atmungskette dreimal drei Moleküle ATP, in der Reaktion 8 ergeben sich durch FADH2-Bildung und Oxidation zwei Moleküle ATP. Dazu kommt das in der Reaktion 7 gebildete GTP, das energetisch äquivalent mit ATP ist.
Der C. steht über Oxalacetat mit der Gluconeogenese in Verbindung. Er ist ferner Ausgangspunkt für die Synthesen mehrerer Aminosäuren, insbesondere von Asparaginsäure und Glutaminsäure und er liefert mit Succinyl-CoA eine Ausgangsverbindung für die Synthese der Porphyrine. Unter Einbeziehung weiterer Zwischenprodukte kann der C. abgewandelt werden. Solche Nebenwege des C. sind der γ-Aminobuttersäureweg (γAminobuttersäure), der Glyoxylatzyklus und der Succinat-Glycin-Zyklus. Die Carboxylierung von Pyruvat ist ein Schritt in der Gluconeogenese aus Pyruvat. Sie ist aber ebenso eine anaplerotische Reaktion des C., d.h., sie hält die Oxalacetat-Konzentration aufrecht, die sich durch Entnahme von Zwischenprodukten des C. für Biosynthesen sonst erschöpfen würde. Bei Tieren ist die Nettosynthese von Kohlenhydraten aus Acetyl-CoA (und damit aus Fettsäuren) nicht möglich. Bei Pflanzen und Tieren erlaubt jedoch der Glyoxylatzyklus die Einführung einer zweiten Acetylgruppe aus Acetyl-CoA, sodass auf diesem Weg eine Nettosynthese von C.-Zwischenprodukten (und damit von Kohlenhydraten) aus C2-Einheiten möglich ist. Dies ist wichtig in Samen für die Verwertung von Ölspeicherstoffen zur Synthese von Kohlenhydraten während der Keimung sowie für das Wachstum von Bakterien auf Kosten einfacher Kohlenstoffquellen, wie z.B. Acetat.
Regulation des C.: ADP/ATP und NAD+/NADH + H+ wirken als Effektoren des C., wobei besonders die Regulation der Isocitrat-Dehydrogenase, eines allosterischen Enzyms, von Bedeutung ist. Das Enzym benötigt ADP als Aktivator. ATP und NADPH wirken als Hemmstoffe ( vgl. Tab. ). Weitere Angriffspunkte einer Regulation sind die Synthese von Oxalacetat und Citrat. Oxalacetat fungiert als Katalysator bei der Oxidation von Acetyl-CoA zu CO2 und wirkt gleichzeitig als Hemmstoff der Succinat-Dehydrogenase und der Malat-Dehydrogenase. Da der C. nur in Verbindung mit der Atmungskette abläuft, wird seine Intensität auch vom Sauerstoffangebot reguliert. Unter Anaerobiose kommt es bei Bildung der reduzierten Coenzyme NADH und FADH2 zum Stillstand des Citratzyklus.
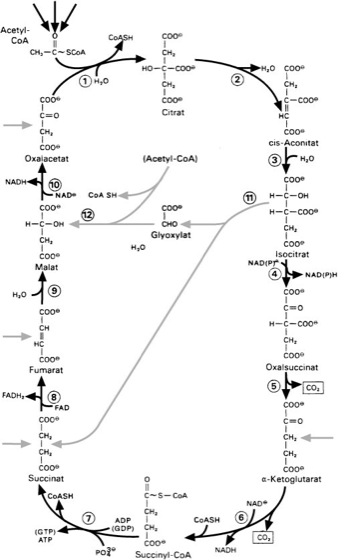
Citratzyklus: Im Citratzyklus werden Acetyl-CoA und Oxalacetat durch die Citrat-Synthase (das so genannte condensing enzyme) unter CoA-Abspaltung addiert. Im Verlauf des Zyklus werden 2 CO2 freigesetzt und die Wasserstoffatome durch vier verschiedene Dehydrogenasen auf insgesamt 3 NAD+ und 1 FAD übertragen, die ihren Wasserstoff zur ATP-Bildung in der Atmungskette weitergeben. Im C. entsteht noch durch eine Substratkettenphosphorylierung ein energiereiches GTP, das dem ATP entspricht. Die einzelnen Reaktionen werden durch folgende Enzyme katalysiert: (1) Citrat-Synthase, (2) und (3) Aconitase, (4) und (5) Isocitrat-Dehydrogenase, (6) α-Ketoglutarat-Dehydrogenase, (7) Succinat-Thiokinase, (8) Succinat-Dehydrogenase (9) Fumarase, (10) Malat-Dehydrogenase, (11) Isocitrat-Lyase, (12) Malat-Synthase. Die hellen äußeren Pfeile bezeichnen die Stellen, an denen Substrate aus anderen Abbauwegen in den C. eingeschleust werden können. Die hellen Linien in der Mitte zeigen die Beziehung zwischen C. und Glyoxylatzyklus, der funktionsfähig ist, wenn den Zellen Acetat als Substrat vorliegt
Schreiben Sie uns!