Kompaktlexikon der Biologie: Glykogen
Glykogen, ein tierisches Polysaccharid, das ähnlich wie Amylopektin α-1→4-glykosidisch aus D-Glucoseresten aufgebaut ist, sich von Amylopektin aber durch einen etwa doppelt so hohen Verzweigungsgrad unterscheidet. Die Verzweigungen kommen durch Seitenketten zustande, die α-1→6-glykosidisch verknüpft sind und aus sechs bis zwölf Glucoseresten bestehen ( vgl. Abb. ). Das relative Molekulargewicht beträgt eins bis 16 Mio. (bis 105 Glucoseeinheiten). G. findet sich besonders in der Leber (bis zu 10 %) und in den Muskeln (bis zu 1 %). Als Reservekohlenhydrat unterliegt G. einem ständigen Auf- und Abbau. Ausgangsverbindung für die Synthese ist Glucose-6-phosphat, das durch eine Phosphoglucomutase in Glucose-1-phosphat umgewandelt wird. Wichtiges katalytisch wirkendes Cosubstrat ist dabei Glucose-1,6-bisphosphat. Die weitere Synthese verläuft über ein aktiviertes Zuckerderivat, die Uridindiphosphatglucose (UDP-Glucose) unter Bildung der ( vgl. Abb. ) α-1→4-glykosidischen Bindung. Die α-1→6-Bindung wird durch eine Transglykosidase katalysiert. Der Abbau des G. (Glykogenolyse) erfolgt phosphorolytisch unter Katalyse der Glykogenphosphorylase. Sie überträgt den Glucoserest vom nicht reduzierenden Ende des Glykogens auf anorganisches Phosphat unter Bildung von Glucose-1-phosphat, das zu Glucose-6-phosphat isomerisiert und dann in den allg. Kohlenhydratabbau (Glykolyse) einfließt. Die 1→6-Verzweigungsstellen werden durch eine Hydrolase gespalten, sodass beim Abbau von G. auch etwa 10 % freie Glucose entstehen.
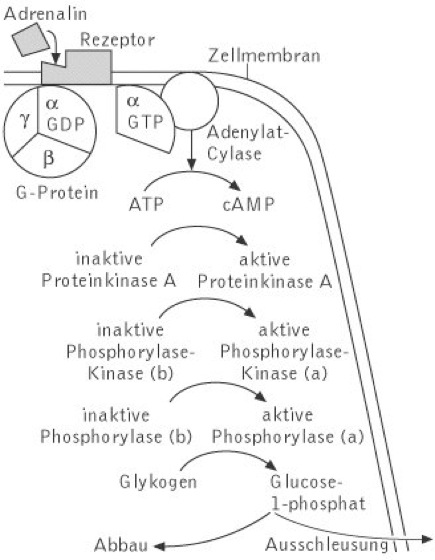
Die Regulation des Glykogenstoffwechsels erfolgt über Enzymumwandlungen: Die Glykogen-Synthase kommt in den Muskeln gewöhnlich in der aktiven Form vor, während die Phosphorylase in ihrer inaktiven Form (b) vorliegt. Diese Phosphorylase b kann nun durch explosionsartiges Aufkommen von AMP aufgrund von Muskelaktivität allosterisch aktiviert werden, sodass die Phosphorylierung einsetzen kann. Jedoch sind hormonelle und nervöse Stimulierungen die wichtigeren Regulatoren des G.-Stoffwechsels. Adrenalin ( vgl. Abb. ) und Glucagon aktivieren die Adenylat-Cyclase, wodurch cAMP (Adenosinphosphate) gebildet wird. Dieses aktiviert eine Reihe von Proteinkinasen, von denen eine die Phosphorylase-Kinase aktiviert und die Glykogen-Synthase hemmt. Die aktivierte Phosphorylase-Kinase a überführt inaktive Phosphorylase b in aktive Phosphorylase a. Diese wird durch Glucose-6-phosphat allosterisch gehemmt, sodass der Glykogenabbau durch Glucose-6-phosphat verlangsamt wird. Zusätzlich wird durch Glucose-6-phosphat die Glycogen-Synthase allosterisch aktiviert.
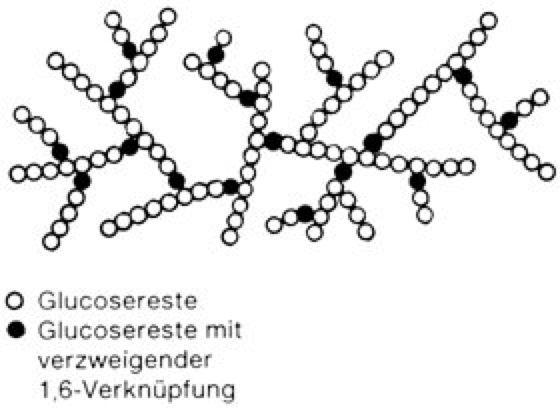
Glykogen: Ausschnitt aus einem Glykogenmolekül

Schreiben Sie uns!