Kompaktlexikon der Biologie: Lactose-Operon
Lactose-Operon, lac-Operon, das Operon, das die Gene enthält, welche für den Lactosemetabolismus von Escherichia coli erforderlich sind. Sie codieren für Enzyme, die die Aufnahme des Disaccharids in die Zelle sowie für dessen Hydrolyse verantwortlich sind. Die Gene des L. – O. werden nur in Anwesenheit von Lactose exprimiert, das für die präferentiell Glucose nutzenden Bakterien eine alternative Energiequelle darstellt. Mit Hilfe des L. – O. haben F. Jacob und J. Monod 1961 das Operon-Modell und das Konzept der messenger-RNA entwickelt. Für ihre Arbeiten erhielten sie, zusammen mit A. Lwoff, 1965 den Nobelpreis.
Durch die Charakterisierung von Mutanten mit gestörtem Lactosestoffwechsel gelang es Jacob und Monod, die drei Gene des L. – O. zu identifizieren, die für Lactose verwertende Enzyme codieren. Sie sind in der Reihenfolge lacZ-lacY-lacA nacheinander im Genom angeordnet. Das lacZ-Gen codiert für das Enzym β-Galactosidase, das Lactose zu Glucose und Galactose umsetzt, das lacY-Gen codiert für eine Galactosid-Permease, die die Aufnahme von Lactose in die Zelle katalysiert. Die Funktion des Enzyms Thiogalactosid-Transacetylase dessen genetische Information im lacA-Gen enthalten ist, konnte bislang nicht ermittelt werden. Zusätzlich enthält das L. – O. noch das lacI-Gen, das nicht für ein Enzym, sondern für ein als Lactose-Repressor (lac-Repressor) bezeichnetes Protein codiert. Es ist für die Regulation der Expression des L. – O. von zentraler Bedeutung.
Auf die Funktion des lac-Repressors als Regulator wurde man aufmerksam, weil bei einer Mutation von lacI die drei Strukturgene des L. – O. auch in Abwesenheit von Lactose konstitutiv exprimiert wurden.
Der lac-Repressor bindet an einen bestimmten Bereich vor dem Promotor der drei Strukturgene, der als Operator bezeichnet wird und verhindert deren Transkription ( vgl. Abb. ). Ist hingegen Lactose im Wachstumsmedium der Bakterien vorhanden, bindet ein Zwischenprodukt des Lactoseabbaus, die Allolactose, an den lac-Repressor; durch die dadurch erfolgende Konformationsänderung des Proteins kann dieses nicht mehr an den Operator binden, sodass die Gene des L. – O. exprimiert werden können. Allolactose, i.w.S. auch Lactose, werden deshalb als Induktoren des L. – O. bezeichnet. Die Repressor-Induktor-Bindung stellt einen Gleichgewichtszustand dar, sodass mit allmählicher Umsetzung der Lactose wieder mehr Repressormoleküle vorhanden sind, die an den Operator binden. Die drei Gene des L. – O., welche die drei für den Lactoseabbau benötigten Enzyme enthalten, unterliegen somit einer negativen Kontrolle; der lac-Repressor wird konstitutiv exprimiert und ist deshalb ständig in der Zelle vorhanden. ( vgl. Abb. )
Neben der Kontrolle durch den lac-Repressor wird das L. – O. auch mittels Katabolitrepression kontrolliert. Hierbei spielt die intrazelluläre Glucosekonzentration eine wichtige Rolle. Im L. – O. befindet sich neben dem Operator noch eine zweite Bindestelle, an die das Katabolit-Aktivatorprotein (CAP) anbinden kann. Geringe Glucosekonzentrationen führen zur Entstehung des CAP-cAMP-Komplexes, der mit der CAP-Bindungsstelle interagiert und ebenfalls die Transkription stimuliert. Ist hingegen viel Glucose und infolgedessen wenig cAMP vorhanden, findet keine Expression des L. – O. statt. Mit diesen beiden Kontrollmechanismen können Bakterienzellen ihren Stoffwechsel koordinieren, wenn z.B. Lactose und Glucose vorhanden sind.
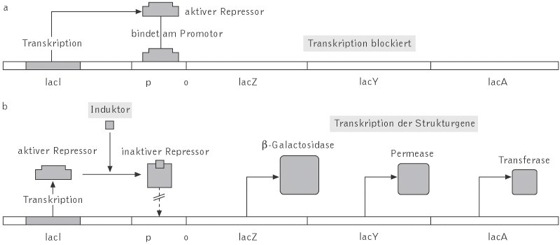
Lactose-Operon: a in Abwesenheit und b in Anwesenheit von Lactose im Wachstumsmedium. Die Regulation mittels CAP-cAMP-Komplex ist nicht dargestellt
Schreiben Sie uns!