Kompaktlexikon der Biologie: Proteine
Proteine, Eiweiße, ausschließlich oder überwiegend aus Aminosäuren aufgebaute makromolekulare Verbindungen, die entscheidender Bestandteil der lebenden Materie sind. So sind z.B. in einer Escherichia-coli-Zelle 3000 verschiedene P. enthalten und im menschlichen Organismus finden sich mehr als 100000 unterschiedliche P. Sie bestimmten Struktur und Funktion jeder Zelle.
Aufbau und Struktur. Am Aufbau der P. sind 20 unterschiedliche Aminosäuren (proteinogene Aminosäuren) beteiligt. Sie sind durch Peptidbindungen miteinander verknüpft, wobei die Reihenfolge der Bausteine (Aminosäuresequenz = Primärstruktur) genetisch festgelegt ist. Sie kann durch Sequenzanalyse (Edman-Abbau) ermittelt werden. P. enthalten i.d.R. mehr als 100 Aminosäuren in einer Polypeptidkette. ( vgl. Abb. )
Unter Sekundärstruktur versteht man die Art und Weise der Kettenfaltung, wie sie durch Ausbildung von Wasserstoffbrücken (H-Brücken) zwischen dem Sauerstoff der Carbonylgruppe und dem Wasserstoff der Amidgruppe einander gegenüber liegender Peptidbindungen zustande kommen. Bilden sich die H-Brücken innerhalb einer Peptidkette aus, kommt es zu einer schraubigen Auffaltung, der Helix (wobei die α-Helix mit 3,6 Aminosäureresten je Windung die häufgste Form ist). Liegen intermolekulare Brücken vor, so entsteht die Faltblattstruktur (β-Struktur; Abb. bei Faltblattstruktur).
Die Tertiärstruktur ist die räumliche Anordnung der als α-, β- oder Zufallsknäuel-Struktur vorliegenden Abschnitte einer Polypeptidkette ( vgl. Abb. ). Die Tertiärstruktur liefert nicht nur Angaben über die Molekülstruktur, sondern auch detaillierte Informationen über die räumliche Anordnung reaktiver Aminosäurereste, z.B. im aktiven Zentrum von Enzymen oder im Antigenbindungsort von Antikörpern (Immunglobulinen). Durch Aufklärung der Tertiärstruktur (mit Hilfe der Röntgenstrukturanalyse) konnten seinerzeit erstmals Enzym-Substrat- und Enzym-Inhibitor-Komplexe sowie die dabei stattfindenden Gestaltveränderungen des Enzymmoleküls sichtbar gemacht und verstanden werden. Am Zustandekommen und an der Stabilisierung der dreidimensionalen Proteinstruktur sind außer den von der Sekundärstruktur her bekannten H-Brücken und den Disulfidbrücken (Disulfidbindung), denen vor allem eine stabilisierende Wirkung zugeschrieben wird, auch folgende schwache Wechselwirkungen beteiligt: Van-der-Waals-Kräfte, Anziehungskräfte zwischen den nicht kovalent verbundenen ungeladenen (–CH3, –CH2OH) oder hydrophoben (z.B. Phenyl-, Leucyl-) Resten sowie elektrostatische Wechselwirkungen zwischen polaren Seitengruppen (z.B. –COO-), die eine Solvatation des Moleküls ermöglichen und Wechselwirkungen zwischen P. und Lösungsmittel. Letztere sind für die natürliche Konformation der P. von Bedeutung. Sie bestehen vorwiegend in der Ausbildung hydrophober Bindungen, insbesondere im unpolaren Molekülinneren, aber auch zum umgebenden Lösungsmittel.
Sekundärstruktur und Tertiärstruktur werden gemeinsam auch als Kettenkonformation bezeichnet. Diese kann sich innerhalb bestimmter Grenzen verändern, sodass die durch Röntgenstrukturanalyse ermittelte Konformation einen von mehreren möglichen Zuständen darstellt, der durch Kristallisation sozusagen „eingefroren“ ist.
Durch Ausbildung intermolekularer Wechselwirkungen (nicht kovalenter Natur) zwischen zwei oder mehreren identischen oder verschiedenen Polypeptidketten können diese zu stabilen oligomeren P. aggregieren oder assoziieren. Diese geordneten Assoziate werden als Quartärstruktur und ihre Polypeptidketten als die Untereinheiten eines P. bezeichnet. In seltenen Fällen sind auch Disulfidbindungen an der Aufrechterhaltung der Quartärstruktur beteiligt. P. mit Quartärstruktur sind weit verbreitet, wobei der größte Teil aus nicht kovalent verbundenen Untereinheiten aufgebaut ist, und P. aus zwei oder vier Untereinheiten deutlich überwiegen. Offensichtlich sind die P. mit Quartärstruktur hinsichtlich der Flexibilität ihrer Gestalt und Aktivität physiologischen Erfordernissen am besten angepasst. Ihre monomeren Formen sind meist inaktiv. Der Nachweis der Quartärstruktur erfolgt entweder nach vorhergehender Dissoziation in die Untereinheiten durch Ultrazentrifugation, Elektrophorese, Ionenaustauschchromatographie u.a., oder am intakten Molekülaggregat durch Elektronenmikroskopie oder durch Röntgen bzw. Neutronenstrukturanalyse.
Eigenschaften der P. Alle P. haben eine hohe relative Molekülmasse Mr, die von 10 kDa (Dalton) bei kleinen Einketten-P. bis zu mehreren Mio. kDa bei P. mit mehreren Untereinheiten betragen kann. Entsprechend ihrer Molekülgröße und -gestalt gehören die P. zu den Kolloiden. Sie dialysieren nicht (Dialyse), bilden keine echten Lösungen, zeigen den Tyndall-Effekt und haben eine relativ hohe Viskosität. Infolge der großen Anzahl ionisierter Gruppen im Molekül haben P. hohe Dipolmomente. Besonders charakteristisch ist die Ampholytnatur der P., die auf der gleichzeitigen Anwesenheit freier saurer und basischer Gruppen im Proteinmolekül beruht. Die Ampholytnatur ist von entscheidender Bedeutung für ihre Pufferwirkung in biologischen Systemen. Aufgrund der Hydratation sind die globulären P. in der Lage, hydrophobe Substanzen einzuschließen und vor Ausflockung zu schützen. Diese Schutzkolloidfunktion ist für die Stabilisierung von Körperflüssigkeiten wichtig.
Werden P. auf über 60 °C erhitzt, so kommt es zu tiefgreifenden strukturellen Veränderungen, die gleichzeitig zum Verlust oder zur Beeinträchtigung der biologischen Aktivität der betreffenden P. führen. Diese Denaturierung beruht auf der Zerstörung der Tertiär- und Quartärstruktur, die auch durch UV- und Röntgenbestrahlung, Behandlung mit starken Säuren oder Basen u.a. hervorgerufen werden kann. Ist die Denaturierung reversibel, kann der native Zustand des P. wiederhergestellt werden (Renaturierung). Bei irreversibler Denaturierung, wie z.B. der Hitzedenaturierung des Ovalbumins beim Kochen des Hühnereies, kommt es zur Ausbildung ungeordneter Gerüstkonformationen, die auch als statistische Knäuel (random coil) bezeichnet werden.
Vorkommen der P. Als Enzyme und Peptidhormone sind P. für den geregelten Ablauf der chemischen Reaktionen des Stoffwechsel verantwortlich, ebenso für die Regulation der Aktivität sowie der Enzyme. Als Struktur-P. (Gerüst-P., Sklero-P.), wie z.B. Kollagen, Elastin, Keratine, sind P. wesentlicher Bestandteil von Stützgewebe, Bindegewebe und Biomembranen. Als kontraktile P. wie Actin und Myosin ermöglichen sie die Kontraktion der Muskeln. Als Immunglobuline oder Interferone bilden sie spezifische körpereigene Abwehrproteine. Als Trägerproteine, wie z.B. Hämoglobin, Serumalbumin oder Transferrin sind P. am Transport von Sauerstoff, Fettsäuren, Hormonen, Medikamenten, Stoffwechselprodukten und Metallionen sowie an Elektronenübertragungsprozessen z.B. der Atmungskette und der Fotosynthese beteiligt. Als Speicherproteine, wie z.B. Eialbumine, Casein der Milch, Gliadin (Weizensamen) oder Zein (Maissamen) sichern sie die Aminosäurereserve des Organismus. Als Rezeptorproteine vermitteln sie die spezifische Wirkung von Wirkstoffmolekülen am Wirkort. Als Zellerkennungsproteine werden sie auf Zelloberflächen präsentiert und ermöglichen so die Erkennung eines Zelltyps durch einen anderen und spielen deshalb eine Rolle bei der Morphogenese und der Erkennung fremden Gewebes (z.B. bei der Transplantatabstoßung). Darüber hinaus sind P. bei der Blutgerinnung, der Spezifizierung der Blutgruppen, der Steuerung der Genaktivitäten und bei der Regulation vieler anderer biochemischer Prozesse von entscheidender Bedeutung. (Translation)

Proteine: Ein Polypeptid oder Protein besitzt ein sich wiederholendes Rückgrat aus Aminosäuren, die durch Peptidbindung miteinander verbunden sind. Dieses Rückgrat bildet die Primärstruktur eines Proteins
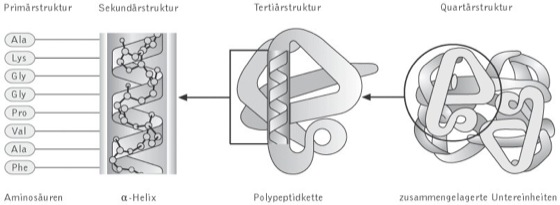
Proteine: Strukturebenen von Proteinen (von links nach rechts). Die Primärstruktur entspricht der Sequenz der durch Peptidbindungen miteinander verbundenen Aminosäuren. Die entstehenden Polypeptide können, wie in vorliegendem Beispiel, zu einer α-Helix gewunden sind, die eine der möglichen Sekundärstrukturen darstellt. Die Helix ist Teil der Tertiärstruktur des gefalteten Polypeptids. Dieses wiederum stellt eine der Untereinheiten dar, welche die Quartärstruktur des multimeren Proteins, im vorliegenden Beispiel des Hämoglobins, bilden
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.