Kompaktlexikon der Biologie: Steroide
Steroide, Verbindungen, die sich von dem tetrazyklischen Kohlenwasserstoff Perhydro-1H-cyclopenta [α]-phenanthren (Trivialname bei unbekannter Stereochemie Steran, bei trans-Stellung der Ringe B/C und C/D Gonan) ableiten. ( vgl. Abb. ) Wichtige Gruppen natürlich vorkommender S. sind die Sterine, die Gallensäuren, die Steroidhormone und die Cardenolide (herzwirksame Glykoside) sowie verschiedene stickstoffhaltige Steroidalkaloide. Zu den S. gehören außerdem zahlreiche Saponine.
Die Ringe A/B, B/C und C/D können cis oder trans miteinander verbunden sein. Bei den natürlich vorkommenden S. sind die Ringe B/C immer trans verknüpft. Die meisten S. leiten sich vom Gonan ab. Bei den Cardenoliden und Bufadienoliden sind die Ringe C/D cis verknüpft. Zahlreiche S. enthalten jedoch Doppelbindungen in den Ringen A oder B und sind dadurch mehr oder weniger stark eingeebnet. Die meisten natürlich vorkommenden S. haben CH3-Gruppen in 13- (z .B. Estran) bzw. 10- und 13-Stellung (z.B. Androstan) sowie eine Sauerstofffunktion (Hydroxy-, Oxogruppe) in 3-Stellung. Sie enthalten meist einen Alkylrest in 17-Stellung. ( vgl. Tab. )
Die Biosynthese erfolgt, ausgehend von Squalen, über Squalenoxid und bei den Säugetieren über Lanosterin zum Cholesterin. Tiere und Pilze bilden als erstes zyklisches Produkt der Sterinbiosynthese das Lanosterin, Algen und höhere Pflanzen das Cycloartenol. Lanosterol und Cycloartenol werden wegen der drei zusätzlichen Methylgruppen (in 4,4 und 14-Stellung) als Methylsterine bezeichnet und zu den Triterpenen gezählt.
S. kommen in Tieren Pflanzen, Mikroorganismen und insbesondere in Pilzen vor. In letzteren sind die Sterine und Steroidcarbonsäuren der Ergostan- und Stigmastanreihe sowie Methylsterine enthalten. Verbreitetstes S. ist das Ergosterin. Die S. der Tiere werden aus Cholesterin gebildet. Aus dem Cholesterin entstehen in den Säugetieren bei weitestgehendem Abbau der Seitenkette am C17-Atom die Steroidhormone (Pregnan-, Androstan- und Estranreihe). Bei den Wirbellosen wirken die Ecdysteroide als Häutungshormone. Aubbauprodukte des Cholesterins sind die Gallensäuren, bei denen es sich um Steroidcarbonsäuren handelt. Die Struktur der pflanzlichen S. ist durch Vergrößerung der Alkylkette am C17-Atom (Stigmastanreihe), durch Bildung zusätzlicher O- und N-haltiger Ringe (Saponine, Steroidalkaloide) oder durch das Vorhandensein eines ungesättigten Lactonringes (Cardenolide, Bufadienolide) wesentlich vielfältiger. Pflanzliche S. liegen meist als Glykoside vor, wobei der Zuckerrest vorwiegend an der 3β-Hydroxygruppe gebunden ist.
Steroidsynthesen haben für die Bereitstellung von Arzneimitteln, insbesondere von Hormonen, große wirtschaftliche Bedeutung.
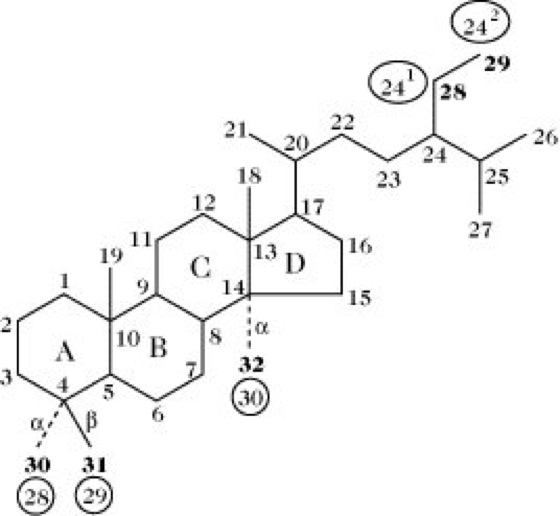
Steroide: Ringnomenklatur und Nummerierung der Kohlenstoffatome im Steroidmolekül. In den Ellipsen angezeigte Nummern entsprechen der IUPAC-Empfehlung von 1989, fettgedruckte der zuvor gültigen von 1969. Alle anderen Nummerierungen blieben unverändert

Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.