Lexikon der Biologie: Alkaloide
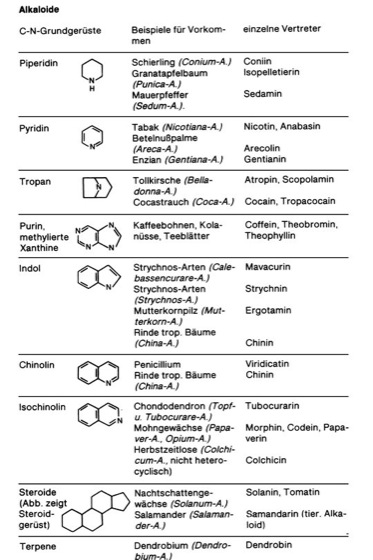
Alkaloide [von *alkali –, griech. ōeidēs = ähnlich], in der Natur vorkommende, in der Regel heterocyclische organische Verbindungen mit einem oder mehreren Stickstoffatomen. Die basische Natur und die Eigenschaft, sich wie Alkalien (Alkali) mit Säuren zu Salzen zu verbinden, haben den Alkaloiden ihren Namen gegeben. Die Alkaloide umfassen mehrere tausend bekannte, hauptsächlich pflanzliche Verbindungen ( vgl. Tab. ) mit meist komplizierten Molekülstrukturen. Die Abgrenzung der Alkaloide zu anderen stickstoffhaltigen Verbindungen ist oft schwierig. Viele Alkaloide sind optisch aktiv, überwiegend linksdrehend; die meisten sind farblos und kristallin. – Vorkommen: Hauptquelle der Alkaloide sind Höhere Pflanzen, jedoch sehr selten Einkeimblättrige Pflanzen(Liliopsida). Die weitaus größte Zahl der Alkaloide stammt aus Zweikeimblättrigen Pflanzen, unter denen wiederum bestimmte Familien gehäuft Alkaloide enthalten, z. B. die Mohngewächse, Nachtschattengewächse, Hahnenfußgewächse, Sauerdorngewächse, Rötegewächse (Krappgewächse), Erdrauchgewächse, Hundsgiftgewächse, Doldenblütler und Schmetterlingsblütler (Hülsenfrüchtler). Aber auch in Mikroorganismen und in Tieren wurden Alkaloide gefunden (z. B. in Salamandern, Kröten, Fischen, marinen Würmern, Gliederfüßern; vgl. Tab. ). Das Auftreten bei Tieren ist jedoch selten, da Alkaloide meist als Nervengifte (Neurotoxine) wirken. Sie sind deshalb auch meist in den Hautdrüsen lokalisiert. Oft treten strukturverwandte Alkaloide in systematisch nahestehenden Pflanzen auf (Hauptalkaloide und Nebenalkaloide), z. B. Atropin und Scopolamin in Nachtschattengewächsen. Nicotin dagegen ist als weitverbreitetes Alkaloid auch innerhalb weiter entfernter Pflanzenfamilien anzutreffen. – Alkaloide werden aufgrund ihrer hohen Stabilität im Stoffwechsel oft als Endprodukte akkumuliert. Sie können in allen Pflanzenteilen vorkommen, werden aber oft in gewissen, von Fall zu Fall verschiedenen Organen gehäuft angetroffen (z. B. in Samen, Rinden, Wurzeln, Blättern, Früchten), während gleichzeitig die übrigen Teile der betreffenden Pflanze alkaloidfrei sein können. Ein Beispiel ist die Kartoffel, deren Knolle völlig alkaloidfrei ist, während die oberirdischen Pflanzenteile Solanin enthalten und deshalb giftig sind. Auch muß der Syntheseort der Alkaloide nicht der Ort der Akkumulation sein. Beispielsweise wird Nicotin in den Wurzeln der Tabakpflanze (Tabak) gebildet, in den Sproß transportiert und in den Blättern akkumuliert. Meist sind die Alkaloide salzartig an Pflanzensäuren (z. B. Oxalsäure, Essigsäure, Milchsäure, Apfelsäure, Weinsäure, Citronensäure und Aconitsäure) gebunden und im Zellsaft der Vakuole gelöst. Eine Selbstvergiftung (Autointoxikation) verhindert die Pflanze durch besondere Exkretzellen, z. B. die Milchröhren der Mohngewächse, deren Absonderungsprodukt, der Milchsaft, neben anderen Substanzen viele Alkaloide (z. B. Morphin) enthält. – Einteilung: Alkaloide können, je nach dem zugrundeliegenden C-N-Gerüst, verschiedenen chemischen Gruppen zugeordnet werden. Viele Alkaloidgruppen werden nach der Pflanzenfamilie oder Tiergruppe bezeichnet, in der sie vorkommen ( vgl. Tab. ). Die meisten Alkaloide tragen Trivialnamen (Zusammenfassung wichtiger Alkaloidgruppen mit Beispielen vgl. Tab. ). – Biosynthese: Alkaloide sind Endprodukte des Sekundärstoffwechsels (Pflanzenstoffe) und werden, wie ihre große Zahl und strukturelle Verschiedenheit vermuten läßt, über eine Vielzahl von Biosynthesewegen gebildet. Ausgangssubstanzen sind oft bekannte Stoffwechselprodukte, z. B. Tyrosin, Tryptophan, Phenylalanin, Lysin, Ornithin, Anthranilsäure, Isoprenoide, Isopentenylpyrophosphat. Ein Beispiel für Konvergenz auch bei Biosynthesen stellt das Coffein dar, das sowohl beim Teestrauch (Teestrauchgewächse) als auch beim Kaffeestrauch (Kaffee) auftritt, jedoch jeweils über verschiedene Wege gebildet wird. – Die Funktion der Alkaloide ist weitgehend unbekannt, vor allem, weil Alkaloide nicht lebensnotwendig sind. Normalerweise alkaloidhaltige Pflanzen können auch alkaloidfrei gezüchtet werden, ohne irgendwelche Eigenschaften einzubüßen. Vereinzelt scheinen Alkaloide als Schutz gegen Pflanzenfresser (pflanzliche Abwehr) oder (manche Pyridinalkaloide) als Vorstufen für Nicotinsäure, die in Form von NAD Cosubstrat vieler enzymatischer Reaktionen ist, zu dienen. Da Stickstoff ein wichtiger und oft begrenzender Faktor des Pflanzenstoffwechsels ist und in der Regel durch Überführung in Substanzen des Stickstoffpools wiederverwertet wird, ist eine Funktion der Alkaloide als Abfallstoffe aus ökonomischen Gründen unwahrscheinlich. – Bedeutung: Alkaloidhaltige Pflanzenextrakte zählen zu den ältesten Drogen der Menschheit (z. B. Opium). Sie wirken spezifisch auf bestimmte Zentren des Nervensystems. Die meisten Alkaloide sind starke Giftstoffe (Gifte), z. B. Strychnin, Coniin, Nicotin, von denen jedoch viele in entsprechender Dosis als Heilmittel dienen, z. B. Morphin,Chinin, Atropin. Andere wiederum werden als Anregungsmittel in Kaffee (Coffein), Tee (Coffein und Theophyllin) und Kakao (Coffein und Theobromin) oder als Betäubungsmittel (Betäubung) und Rauschgifte (Halluzinogene) verwendet. Hierher gehören z. B. Derivate der Lysergsäure und das Psilocybin. Neben der Toxizität mancher Alkaloide ist auch die euphorisierende Wirkung beim Menschen eine Gefahr, da sie, z. B. besonders bei Morphin und Cocain, zu Gewöhnung und Sucht führt. Manche Alkaloide, wie z. B. die Vincaalkaloide, besitzen cytostatische Eigenschaften: sie hemmen die Zellteilung in der Metaphase. Hydrophile Alkaloide, deren Ring mehrere Hydroxy-(OH-) oder Hydroxymethyl-(CH2–OH-)Gruppen aufweist, zeigen eine strukturelle Ähnlichkeit mit einfachen Zuckern, wie Glucose, Fructose oder Mannose. Diese Strukturanalogie führt dazu, daß selbst Glykosidasen solche Alkaloide mit Zuckern "verwechseln", was zu einer Hemmung dieser Enzyme führt. Da Glykosidasen auch an der Synthese von Glykoproteinen beteiligt sind, die bei der Umwandlung normaler Zellen in Krebszellen sowie bei deren Ausbreitung (Metastasenbildung; Metastasierung) eine Rolle spielen, könnten die genannten Alkaloide unter Umständen als Glykosidase-Hemmer in der Krebstherapie eingesetzt werden. Bei Experimenten mit dem HIV (AIDS-Virus; AIDS) zeigte sich, daß das Alkaloid Castanospermin sowie zwei ähnliche Alkaloide die Fähigkeit des Virus, Zellkulturen zu infizieren, stark herabsetzten – vermutlich dadurch, daß sie ein für die Infektion neuer Zellen notwendiges Oberflächenglykoprotein veränderten. – Pflanzen schützen sich durch zuckerähnliche Alkaloide vor Insektenfraß. Die Alkaloide blockieren nämlich die im Mundbereich der Insekten gelegenen Zuckerrezeptoren und unterbinden so die Zuckerwahrnehmung, was die Insekten veranlaßt, bei ihrer Nahrungssuche andere Pflanzen aufzusuchen. Zuckerähnliche Alkaloide könnten somit auch als biologische Schädlingsbekämpfungsmittel (biologische Schädlingsbekämpfung) zum Schutz von Kulturpflanzen eingesetzt werden. – Von Pflanzen synthetisierte Alkaloide dienen manchen Insekten, die diese Substanzen mit der Nahrung aufnehmen und speichern, dazu, Fraßfeinde abzuschrecken. Beispiele: Die Anreicherung von herzwirksamen Steroidglykosiden in Schmetterlingslarven (z. B. in der Raupe des Monarchs, Danaus plexippus) oder die Aufnahme von Pyrrolizidinalkaloiden aus dem Grauen Alpendost(Adenostyles alliariae) durch den Blattkäfer Oreina cacaliae. Allelopathie, biogene Amine, Braun (J. von), Caventou (J.B.), Heilpflanzen, Hydroxyzimtsäuren, Karrer (P.), Krötengifte, Mitosegifte, Mothes (K.A.), Pelletier (P.J.), Pflanzengifte, Pflanzenstoffe, Pictet (A.), Robinson (R.), Sertürner (F.W.A.), Skraup (Z.H.), Tiergifte, Willstätter (R.).
E.R.
Lit.:Luckner, M., Mothes, K., Schütte, H.R.: Biochemistry of alkaloids. Berlin 1983.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.