Lexikon der Biologie: Altern
ESSAY
Klaus-Günter Collatz
Altern
Unübersichtliche Terminologie
Jeder, der sich mit dem Problem des Alterns befaßt, wird bald auf terminologische Unklarheiten stoßen, auf Schwierigkeiten bei der Definition von Begriffen wie Entwicklung, Seneszenz, programmiertes Altern, programmierte Seneszenz, programmierter Tod. Zum Teil werden diese Begriffe synonym verwendet, und nicht alle Autoren meinen dasselbe, wenn sie z. B. von Seneszenz sprechen. Es scheint daher notwendig, diese Termini etwas näher zu erläutern.
Schon der Begriff "Altern" selbst ist unscharf und – in der Alltagssprache gebraucht – negativ belastet: Ein Kind entwickelt sich, es wird älter, aber es altert nicht. Ab wann "altert" ein Organismus überhaupt? Pubertät ist zwar eine Alternserscheinung, hat aber nichts mit Seneszenz zu tun. Unbelebte Dinge wie Teller und Tassen in einem Hotel altern (in dem Sinne, daß sie eine begrenzte Lebensdauer besitzen). Die Wahrscheinlichkeit, daß eine Tasse "stirbt", ist aber zu jedem Zeitpunkt gleich, d. h., die alternsspezifische "Mortalität" ist konstant, die "Überlebenskurve" einer derartigen Population hat die Form einer Exponentialfunktion (wie z. B. auch bei Tieren, die in freier Wildbahn vor Erreichen einer Seneszenzphase gefressen werden, – aber auch noch in der mitteleuropäischen Bevölkerung vor 200 Jahren). Die Wissenschaft vom Alter müßte eigentlich "Geratologie" und nicht "Gerontologie" heißen, denn "geras" heißt im Griechischen das Alter, wogegen "geron" der Greis ist. Aus "geron" und "hiatreuo" (ich heile) wird Geriatrie, die medizinische Alternsforschung.
Betrachtet man Altern unter vergleichend biologischen Gesichtspunkten, ist es zweckmäßig, die umfassendste Definition für diesen innerhalb der Organismen sehr heterogenen Prozeß zu wählen: Altern ist eine irreversible zeitabhängige Veränderung von Struktur und Funktion lebender Systeme. (Der Begriff "Alterung" sollte für unbelebte Systeme verwendet werden.) Generell ist das Altern eines Organismus durch die Abnahme seiner Adaptationsfähigkeit (Adaptation) gegenüber Umwelteinflüssen geprägt. Physiologische Mechanismen, die der Aufrechterhaltung des inneren Milieus (C. Bernard) dienen, laufen nicht mehr mit genügender Schnelligkeit und Präzision ab, die Homöostase ist gestört. Als Konsequenz des Alternsganges steigt die Mortalitätsrate (Mortalität; je nach Organismus und innerhalb verschiedener Populationen durchaus unterschiedlich), die Vitalität sinkt. "Vitalität" kann man auch mit "biologischem Alter" gleichsetzen (s. u.), der Begriff wird aber ebenfalls unterschiedlich benutzt.
Altern soll zumindest per definitionem von Krankheit getrennt werden (was in der Praxis nicht leicht ist). Um dies zu ermöglichen, sind von Bernhard Strehler die 4 sog. Alternskriterien "universality, progressiveness, deleteriousness, intrinsicalty" eingeführt worden. Von ihnen ist der letzte am schwierigsten zu beurteilen, da innerhalb verschiedener Populationen einer Art, die unter verschiedenen Umweltbedingungen leben, durchaus unterschiedliche Alternsverläufe zu beobachten sind.
Die hier benutzte breite Definition des Begriffs Altern erlaubt es, ihn von Seneszenz zu unterscheiden. Mit Seneszenz soll nur der Prozeß einer graduellen und langsamen Akkumulierung schädlicher Effekte beschrieben werden. Altern kann von Seneszenz begleitet sein, wie dies bei Säugetieren generell der Fall ist, wenn sie überhaupt den entsprechenden Lebensabschnitt erreichen. Andererseits wird man den Tod vieler Insekten oder auch den von Lachsen unmittelbar nach und gekoppelt an eine erfolgreiche Fortpflanzung kaum mit Seneszenz in Verbindung bringen, obwohl es sich eindeutig um das Ende eines Alternsprozesses handelt. Den Beginn der Seneszenz auf irgendeinen Zeitraum nach Beendigung der Reproduktionsphase festzulegen, ist ebenfalls eine willkürliche Entscheidung. Sowohl Wirbeltiere als auch Wirbellose zeigen Seneszenzerscheinungen (z. B. Akkumulation des Alterungspigments Lipofuscin lange vor Ende der Fortpflanzungszeit). Von Wasserflöhen und Skorpionsfliegen, deren Altern auch im Freiland von Seneszenz begleitet ist, ist bekannt, daß sie bis zu ihrem Lebensende fertile Eier legen. (Zur Seneszenz von Pflanzen s. u.)
Ein weiterer alternsbezogener Begriff ist "Entwicklung". Entwicklung kann als eine Form des Alterns angesehen werden, bzw. Altern ist die Fortsetzung und der Abschluß der Entwicklung, wobei die Grenze zwischen beiden nicht zu definieren ist. In der Regel wird allerdings Embryonalentwicklung oder Larvalentwicklung nicht unter dem Gesichtspunkt "Altern" betrachtet. Es darf aber angenommen werden – ohne daß es hierzu viele Belege gäbe –, daß die Embryonalentwicklung eines Wirbeltieres, die Entwicklung eines hemimetabolen Insekts oder die Metamorphose eines Frosches bzw. holometabolen Insekts durchaus unterschiedliche Einflüsse auf die sich anschließende Adultlebensphase nehmen.
In der Alternsliteratur ist häufig von "Programm" die Rede, das im Sinne von "programmiertem Altern" oder "programmiertem Tod" gebraucht wird. In Übereinstimmung mit der hier verwendeten Definition für Altern meint programmiertes Altern nichts anderes als die genetisch gesteuerte Entwicklung und Differenzierung, in welchem Sinne der Terminus insbesondere bei Studium des Alterns von Zellen verwendet wird. Eine andere Frage ist, ob es so etwas wie eine "programmierte Seneszenz" gibt. Hierüber wird viel diskutiert. Nach allem, was man über dieses komplexe Syndrom einzelner Effekte, die den Organismus an seinen verschiedensten Stellen treffen, weiß, ist es ganz unwahrscheinlich, daß man hier von einem Programm sprechen kann. Wenn dagegen spezifische physiologische Ereignisse in der Weise auf den Organismus wirken, daß sein Tod unabdingbar kurz nach dem Beginn dieser Ereignisse auftritt, kann dies als Todesprogramm oder "programmierter Tod" bezeichnet werden. Da der programmierte Tod direkt oder indirekt an eine hormonelle Umstellung im Zusammenhang mit dem Fortpflanzungsgeschehen geknüpft ist, wird er auch als Fortpflanzungstod bezeichnet und ist als solcher sowohl bei Insekten als auch bei Wirbeltieren verbreitet (s. u.).
Beginn der modernen wissenschaftlichen Gerontologie
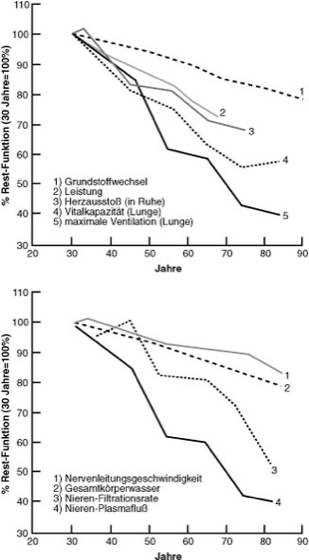
Die Biologie hat sich in systematischer Weise erst sehr spät des alten und alternden Organismus angenommen. Längst war die Entwicklungsbiologie, die sich dem Beginn der Existenz eines Individuums zuwendet, etabliert, bevor auch die Prozesse, die zu seinem Ende führen, Aufmerksamkeit fanden. Die Etablierung der Wissenschaft vom Altern als eigenständiges Teilgebiet der experimentellen Biologie verbindet sich mit dem Internisten Max Bürger und dem Physiologen Fritz Verzár (1886–1979). Ein von Verzár im Jahre 1954 in Basel veranstaltetes Symposium über "Experimentelle Alternsforschung" war das erste dieser Art. Mit der bald darauf gegründeten Zeitschrift "Gerontologia" erschien ein Organ, das die Möglichkeit eröffnete, die bisher verstreuten Arbeiten zu Fragen von Altern, Lebensdauer und Tod der Organismen zentraler zu publizieren. Diese Fachzeitschrift war jedoch nicht die erste in diesem Zusammenhang: zuvor schon – im Jahre 1939 – hätte die von Bürger und Emil Abderhalden gegründete "Zeitschrift für Alternsforschung" das gleiche leisten können, wäre nicht der Krieg dem entgegengestanden. Wenn von Entwicklung einerseits und Altern andererseits die Rede ist, dann erscheint diese Trennung, wie bereits oben angedeutet, einigermaßen künstlich. Es war ebenfalls Max Bürger, der erstmalig erkannt hat, daß Entwicklung und Altern eine Einheit bilden, daß Altern das Ende der Entwicklung eines Lebewesens einleitet, ohne daß zu sagen wäre, wann dieser Prozeß beginnt. Bürger definierte demgemäß Altern als "... jede irreversible Veränderung der lebenden Substanz als Funktion der Zeit" und führte – auf den Menschen bezogen – in diesem Zusammenhang den Begriff der Biomorphose ein: "diese lebenslang dauernden Wandlungen, denen der menschliche Körper, sein Geist und seine Seele unterliegen, habe ich Biomorphose genannt". Mit dieser Definition ist aber auch die Individualität des Alternsschicksals jedes einzelnen Menschen gekennzeichnet, und es spricht nichts dagegen, diese Vorstellung auch auf andere Organismen zu übertragen. Sowohl die genetische Variabilität als auch die Auseinandersetzung mit wechselnden Umweltbedingungen prägen Entwicklung und Alter des Individuums. Wenn die Alltagssprache einem älteren Menschen gegenüber formuliert "er sieht aus wie 40", so steckt implizit dahinter, daß es einen typisch 40-Jährigen gibt, dessen Physiognomie, Physiologie und Verhalten durch einen Satz von Parametern gekennzeichnet sind, die sein chronologisches Alter ausmachen und die bei dem so apostrophierten Älteren eine Diskrepanz zwischen chronologischem und biologischem Alter anzeigen. Insbesondere in der Geriatrie hat diese Vorstellung zur Ausarbeitung von sog. Testbatterien geführt, anhand derer versucht wird, das biologische Alter des Individuums zu quantifizieren. Derartige Testbatterien umfassen z. B. die Messung des Blutdrucks, der Vitalkapazität, Pulsfrequenz vor und nach Belastung, Sauerstoffgehalt im Blut, Handkraft, Gelenkbeweglichkeit, Zustand der Zähne sowie Hör- und Sehvermögen. Darüber hinaus werden psychische Parameter wie Reaktionszeiten, Konzentrations- und Koordinierungsfähigkeit sowie Gedächtnisleistungen gemessen, auch soziale Verhaltensweisen gehen in diese Untersuchungen ein. Die Hoffnung bei derartigen Messungen gründet sich auf die Möglichkeit der Prävention gegenüber den verschiedensten Risikofaktoren.
Alternstheorien
Es existieren derzeit mehr als 300 verschiedene Alternstheorien. Sie können in die folgenden Gruppen zusammengefaßt werden.
1) Theorien, die auf der Beschreibung von Alternsveränderungen basieren:
Sie gehören zu den ältesten Alternstheorien, da sie versuchen, aus der Beschreibung von Veränderungen, die ein Organismus von seiner Jugend bis zu seinem Tode erfährt, den Alternsprozeß zu erklären. Solche Veränderungen werden als Vernetzung von DNA und Proteinmolekülen beschrieben ("cross-linkage theories"). Sie betreffen post-translationale Modifikationen von Struktur und Funktion von Enzym- und anderen Proteinen sowie ihre quantitativen Veränderungen. Einige dieser Theorien behandeln ganz spezifische Organe und Gewebe (z. B. Augenlinsenproteine, kernlose Erythrocyten, Knochen- und Zahnverfall usw.) und dürfen daher von vornherein keine Allgemeingültigkeit beanspruchen.
2) Theorien, die das Altern auf wenige endogene oder exogene Faktoren zurückführen:
Die beobachteten irreversiblen Veränderungen im Alter wären dann die Folgen derartiger Schädigungen. Eine "klassische" Vorstellung ist in diesem Zusammenhang die von der Autointoxikation (I.I. Metschnikow, 1904), zu den moderneren gehört die "free radical theory", die zusammengefaßt mit der älteren "rate of living theory" besagt, daß die Alternsrate eines Lebewesens direkt korreliert ist mit der Rate unreparierter Molekülschädigungen, die durch endogene oder exogene freie Radikale hervorgerufen werden und die umgekehrt korreliert ist mit der Effizienz von Antioxidations- (Antioxidantien) und Reparaturmechanismen (DNA-Reparatur).
3) Theorien, die mit einem genetischen Alternsprogramm operieren:
Hierzu sind die Vorstellungen zu zählen, die Altern und Entwicklung nicht trennen und vom Alternsprozeß als einer Fortsetzung der Entwicklung sprechen. Dabei können einerseits pleiotrope Gene eine Rolle spielen, deren Expression die Vitalität in frühen Entwicklungsstadien erhöht und damit einen hohen Fortpflanzungserfolg garantiert, die sich aber schädlich auf die Überlebenschance in späteren Stadien auswirken (s. u.). Andererseits wird auch über die Existenz von spezifischen Genen diskutiert, die als Regulatorgene für Langlebigkeit verantwortlich sind. Demnach ist z. B. der rapide Anstieg der maximalen Lebensdauer innerhalb der Primatenevolution auf das Zusammenwirken relativ weniger Regulatorgene zurückzuführen (s. u.). Spektakuläre Beispiele für streng genetisch kontrollierte Lebensabläufe finden sich sowohl bei Pflanzen (annuelle Gewächse) als auch bei Tieren (Fortpflanzungstod). Auf der Ebene von Zellen kann man zeigen, daß eine Unterbrechung des Differenzierungsprogramms zu einer Unterbrechung des Zellalterns führt – bis hin zur Transformation in unsterbliche Zellen.
4) Mathematische Theorien:
Bei diesen Theorien werden Modelle erarbeitet, die Mortalitätskinetiken simulieren und den Einfluß verschiedener endogener und exogener Faktoren auf Alternsstruktur und Dynamik von Populationen sowohl beschreiben als auch prognostizieren. Auf das Individuum bezogen, lautet eine der zentralen Aussagen, daß die Komplexität des Alternsprozesses – ebenso wie die der Ontogenese – nur über eine Systemanalyse erfaßt werden kann. Einzelne metabolische Vorgänge, die in ganz unterschiedlicher Weise für den Alternsprozeß verantwortlich sind, sind netzartig miteinander verknüpft und wirken aufeinander ein, ohne daß man zunächst sagen könnte, daß ein Teilaspekt dieser Interaktionen wichtiger als der andere sei. Allein die sicher zutreffende Beschreibung der Seneszenz als einer Störung der Homöostase umfaßt derartig viele Prozesse, daß es nicht vorstellbar ist, sie durch die Erkenntnis der limitierten Proliferationskapazität einzelner Zellen oder durch Effekte einzelner Faktoren (z. B. Fehler bei der Translation, Schäden durch freie Radikale usw.) erklären zu können. Altern wird in diesem Zusammenhang als "multi-rate-limiting-events-process" aufgefaßt, der in all seiner Komplexität beschrieben werden muß, bevor man hoffen kann, eventuell das am meisten limitierende Ereignis ausfindig zu machen. Es liegt auf der Hand, daß auch unter diesem Gesichtspunkt eine vergleichend biologische Untersuchung von Alternsprozessen erforderlich ist.
5) Evolutionstheorien:
Die bisher erwähnten Theorien sind "proximate Theorien": sie versuchen das "wie" des Alternsvorgangs zu erklären. Die Fragen nach dem "warum" der vielfältigen Unterschiede im zeitlichen Ablauf zwischen Entwicklungszyklen und Lebensdauer verschiedener Organismen sind aber am ehesten unter phylogenetischen Aspekten begründbar. Die Evolutionstheorie des Alterns erfordert also eine ultimate Betrachtungsweise, die Betrachtung einer "life history strategy". Zentraler Punkt und das theoretische Konzept, das sich hinter diesen Studien verbirgt, ist die Frage, welche Möglichkeiten es gibt, unter verschiedenen Umweltbedingungen (biotischen und abiotischen Faktoren) eine möglichst hohe reproduktive Fitness (Adaptationswert, inclusive fitness) zu erlangen, d. h., möglichst häufig im Genpool der nächsten Generation vertreten zu sein. Die Fitness ist eine mathematisch exakt errechenbare Größe.
Unterschiedliche "Lebensstile" verlangen unterschiedliche Kompromisse ("trade-offs") zwischen physiologischen Leistungen, die dem Lebenserhalt, und solchen, die der Reproduktion dienen, da sehr häufig die exogenen und immer die endogenen Ressourcen, derer sich ein Organismus bedienen kann, begrenzt sind ("constraints").
Die Lebensdauer selbst ist eine Arteigenschaft und ein Teil der ökologischen Nische einer Art. Dabei hängt die Lebensdauer immer mit der Art der Fortpflanzung zusammen. Zur Erlangung einer hohen reproduktiven Fitness gibt es unterschiedliche Fortpflanzungsstrategien, deren Extreme in der Populationsgenetik als r-Strategie oder K-Strategie (auch r- bzw K-Selektion genannt) beschrieben werden (Selektion, Strategie). Beide Lebensformtypen sind an unterschiedliche Lebensdauern gebunden. Typische "r-Strategen" (z. B. solche Tiere, die unter einem sehr hohen Feinddruck stehen oder deren Nahrung nur kurzfristig in ausreichender Menge erlangt werden kann) besitzen eine kurze Lebensdauer bei explosionsartiger Vermehrung. Sie investieren von den vorhandenen Ressourcen viel in die Nachkommen und wenig in die Aufrechterhaltung der Körperintegrität. Umgekehrt verhält es sich bei typischen "K-Strategen". Die "disposable soma theory" des Alterns versucht, derartige Allokationen (Allokation) von begrenzten Energievorräten zu quantifizieren, woraus sich bestimmte "Alternsformtypen" ableiten lassen sollten. An hierzu notwendigen zahlreichen vergleichenden Untersuchungen zum Altern von Tieren und Pflanzen fehlt es allerdings bisher.
Die Selektion auf eine artspezifische Lebensdauer kann selbstverständlich nur während der Fortpflanzungsperiode wirksam sein. Nach der Vorstellung vom Wirken pleiotroper Gene werden sich mit zunehmendem Alter mehr und mehr schädliche Genprodukte anhäufen, weil der Selektionsdruck gegen sie nach dem Maximum der Reproduktionsrate mehr und mehr nachläßt.
Evolution der Lebensdauer von Primaten
Verschiedene, auch nahe verwandte Säugetierarten altern mit unterschiedlicher Geschwindigkeit. Die potentielle maximale Lebensspanne ("maximum lifespan potential, MLP", definiert als die gemessene Lebensdauer des letzten Überlebenden einer Population) reicht innerhalb der Primaten von 8 Jahren (Tupaias) bis zu 120 Jahren (Mensch; vgl. unten). Der Mensch hat somit die größte MLP nicht nur unter den Primaten, sondern auch unter allen Säugern. Alternsraten und MLPs müssen theoretisch nicht von vornherein korreliert sein. Vergleicht man aber die Geschwindigkeit der Abnahme physiologischer Funktionen in Abhängigkeit vom Lebensalter verschiedener Säuger, so stimmt sie sehr gut mit der MLP überein. Die Alltagsvorstellung, "7 Hundejahre sind ein Menschenjahr", hat einen durchaus realen Hintergrund. Der Schimpanse lebt halb so lange wie der Mensch und hat die doppelte Alternsgeschwindigkeit. Mit zunehmender MLP verlängern sich alle Lebensabschnitte proportional und nicht nur die Seneszenzphase. Dies gilt entsprechend auch für die anderen Primaten.
Aus umfangreichen vergleichenden Untersuchungen rezenter Säugetiere weiß man, daß innerhalb einer systematischen Einheit die MLP recht gut mit der Gehirnmasse und der Körpermasse (auch als "Cephalisationskoeffizient" ausgedrückt) sowie mit dem Grundstoffwechsel korreliert ist. In Anwendung des Aktualitätsprinzips, demgemäß der Evolutionsbiologe nur solche Evolutionsfaktoren gelten läßt, die auch heute wirksam sind, konnte daher der Versuch unternommen werden, die MLP auch für fossile Primaten zu rekonstruieren, um sich so ein Bild über die Evolution der MLP des Menschen zu verschaffen (Paläanthropologie). Demnach hat sich die MLP der Anthropomorphidae während der letzten 3 Millionen Jahre verdoppelt, und diese Zunahme verlief nicht linear, sondern progressiv mit einem Maximum von 1,4 Jahren pro 10 000 Jahre Evolutionsspanne während der letzten 100 000 Jahre. In der Ausstattung an Strukturgenen sind Mensch und Schimpanse nahezu identisch, bei 50 untersuchten Proteinen ergab sich eine 99%ige Übereinstimmung der Aminosäuresequenzen (Sequenzstammbaum). Für die schnelle Zunahme der MLP dürften daher Mutationen auf dem Niveau der Regulatorgene verantwortlich zu machen sein.
Inzwischen ist den meisten Gerontologen bewußt, daß das Altern nicht auf eine einzige Ursache zurückzuführen ist. Verschiedene Theorien beschreiben verschiedene Prozesse des Alterns. Theorien, die versuchen, die einzelnen Prozesse zu einem Gesamtbild zu fügen, können derzeit nicht mehr leisten, als die Überschneidungsbereiche der Einzeltheorien zu charakterisieren und präzise Methoden zu formulieren, nach denen dieser oder jener Aspekt getestet werden kann.
Alternsstatistik
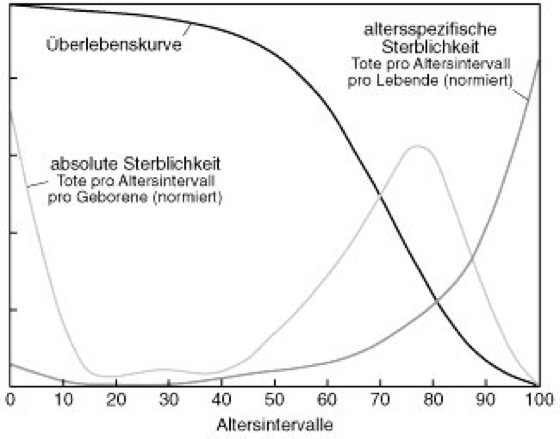
Grundlage der Beschreibung von Altersstruktur und Alternsgeschwindigkeit ist die Alternsstatistik. Sie kann sich an Longitudinal- oder Transversalstudien orientieren. Organismen, die eine kurze Lebensspanne besitzen und deren Alternsverlauf z. B. im Labor leicht zu verfolgen ist, da sie in großen Populationen gezüchtet werden können, eignen sich für erstere. Für eine Transversalstudie (z. B. in menschlichen Populationen) werden Gruppen verschiedenen Alters genommen und zu einem definierten Zeitpunkt verglichen. Da die unterschiedliche Vorgeschichte der so ausgewählten Altersgruppen eine wesentliche Rolle für den Alternsverlauf spielt, sind verallgemeinernde Aussagen über einen "typischen" Alternsablauf sicherer in einer Longitudinalstudie zu treffen. Alternsuntersuchungen am Menschen kombinieren daher beide Methoden, indem einzelne Altersgruppen ausgewählt und deren Alternsverläufe über einen möglichst langen Zeitraum verfolgt werden. Aus den normierten Ergebnissen derartiger Studien (menschliche Populationen auf 100 000, tierische Populationen meist auf 10 000 – oder Angaben in Prozent) lassen sich Überlebenskurven (Überlebende in einem Altersintervall), absolute Sterblichkeitsrate (Tote pro Altersintervall), altersspezifische Sterblichkeitsrate (Tote pro Altersintervall pro Lebende) und Lebenserwartung (Integral unter der Lebenskurve) berechnen ( vgl. Abb. 1 ). Wird die Kurve der altersspezifischen Sterblichkeitsrate logarithmiert, so erhält man die in der Alternsstatistik schon seit 1827 bekannte Gompertz-Kurve (benannt nach dem Engländer Benjamin Gompertz). Erhält man bei der Analyse der altersspezifischen Sterblichkeit einer Population in der logarithmischen Auftragung eine Gerade, kann man schließen, daß die Überlebenskurve exponentiell abfällt, womit die Sterblichkeit exponentiell zunimmt. Alternsstatistiken führen schließlich zur Erstellung von Bevölkerungspyramiden (Altersgliederung).
Alternsmechanismen tierischer Organismen
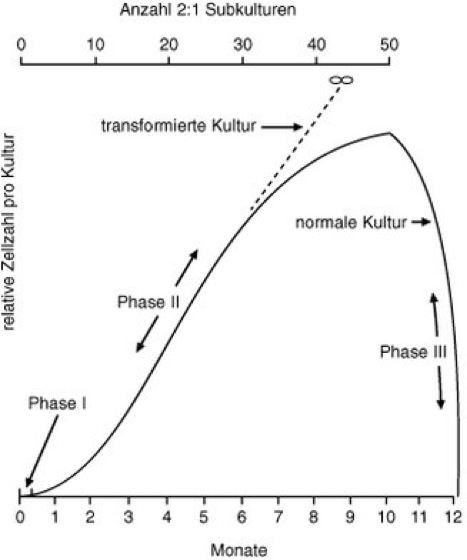
Aus der unterschiedlichen Länge der maximalen Lebensdauer von Organismen ergibt sich, wie bereits angedeutet, daß dem Altern eine genetische Komponente zugrundeliegt. Durch genetische Manipulation kann die maximale Lebensspanne von Drosophila melanogaster und Fadenwürmern (Caenorhabditis elegans; Rhabditida) um mehr als 40% verlängert werden. Außerdem leben Hybridstämme von Versuchstieren in der Regel länger als von ihnen abgeleitete Inzuchtstämme. Auf zellulärer Ebene drückt sich der genetische Einfluß auf die Lebenslänge in einer begrenzten Kapazität der Proliferationen verschiedener Zelltypen unter Kulturbedingungen aus. Besonders gut untersucht ist die replikative Seneszenz von Fibroblastenzellen (Fibroblasten; wobei "Seneszenz" hier Alternsprogramm meint). Sie teilen sich etwa 50mal und durchlaufen dabei auffällige morphologische Veränderungen, die in definierte Stadien eingeteilt werden können ( vgl. Abb. 2 ). Zunächst liegen die Zellen locker verstreut in der Zellkultur und bilden dann eine zusammenhängende (konfluente) Schicht (Phase I). Es folgen weitere rapide Zellteilungen, die es notwendig machen, in definierten Zeitabständen Subkulturen anzulegen (Phase II). Später nimmt die Zellteilungsgeschwindigkeit ab, und es kommt zum Stillstand der Zellteilung (Phase III). Die Zellen überleben als "postmitotische" Zellen noch etwa 3 Monate und sterben dann ab. Diese Zellelimination ist ebenfalls streng programmiert ("programmierter Selbstmord"; Apoptose). Gelegentlich tauchen in Phase II Zellen auf, die nicht postmitotisch werden, sondern sich weiter teilen und dann eine sog. transformierte Kultur bilden. Derart veränderte Zellen zeigen krebsartiges Wachstum. Eine Korrelation der Anzahl von Populationsverdopplungen mit der maximalen Lebensdauer des untersuchten Organismus ist verschiedentlich nachgewiesen, aber nicht durchgängig beobachtet worden. Mit der genaueren Untersuchung der genfreien Schutzkappen an den Enden der Chromosomen, die als Telomere bezeichnet werden, hat man einen Zugang zu der Frage gewonnen, wie die Anzahl der Zellteilungen im Organismus registriert wird. Bei jeder Zellteilung verkürzen sich die Telomere um ein definiertes Stück. Sind die Telomere weit genug verkürzt, erhält die Zelle das Apoptosesignal. Eine Telomerverkürzung kann nur mit Hilfe des Enzyms Telomerase rückgängig gemacht werden. Die Telomerase ist aber normalerweise nur in Embryonalzellen aktiv. Zellen, die der Apoptose entgehen, zeigen ebenfalls Telomeraseaktivität, wenn auch bei schon verkürzten Telomeren. Kürzlich ist es gelungen, Klone von Epithel- und Fibroblastenzellen zu erzeugen, die aktive Telomerasen besitzen. Derartige Klone durchlaufen mindestens 20 weitere Teilungsschritte und behalten eine Zellstruktur, wie sie einer jugendlichen Zelle entspricht – und nicht etwa einer Krebszelle.
Aus Untersuchungen von genetischen Syndromen des Menschen, die möglicherweise für den Alternsprozeß relevant sein können, wurde geschlossen, daß etwa 7000 Regulatorgene das Altern bestimmen. Derartige Transkriptionsfaktoren, die andere Genprogramme starten, sind auch bei Pilzen gefunden worden; ihr Fehlen erhöht die Lebensdauer der Zellen, die dann aber bald transformiert werden. Näher charakterisiert wurde ein Transkriptionsfaktor "MORF4" (Mortality factor from chromosome 4), der bei Hirntumor- und Gebärmutterkrebszellen fehlt. Andere alternsbestimmende Gene, wie das clock-1-Gen und das age-Gen bei Fadenwürmern, greifen wahrscheinlich in den Antioxidationsstoffwechsel ein und regeln somit die Balance zwischen Antioxidantien und freien Radikalen (s. u.). Eine Überexprimierung des Gens für die Superoxid-Dismutase verlängert die Lebensdauer von Drosophila. Mit zunehmendem Alter verringert sich die Präzision, mit der die Zellfunktionen genetisch gesteuert werden, weil spontan an der DNA auftretende Schäden nur noch unzureichend repariert werden. Dies betrifft im wesentlichen die Mechanismen der Exzisionsreparatur. Daneben sind die erwähnten, im Alter gehäuft auftretenden Fehler in der DNA-Polymerase gefunden worden, die dazu führen, daß die katalytischen Eigenschaften des Enzyms mit zunehmenden Zellpopulationsverdopplungen unpräziser werden. Man hat unter anderem diesen Befund als Bestätigung der error-catastrophe-Theorie des Alterns deuten wollen – eine Theorie, die annimmt, daß es durch Selbstverstärkung von Fehlern zu einem Rückkopplungseffekt speziell bei der DNA-Replikation kommt. Inzwischen kann diese – nach ihrem Begründer auch Orgel-Hypothese genannte – Vorstellung nicht mehr aufrechterhalten werden. Es zeigte sich, daß einzig in Zellkulturen eine Änderung der Polymerase auftritt. α- und β-DNA-Polymerasen aus Gehirn, Leber und Lymphocyten zeigten keine Veränderung der katalytischen Eigenschaften im Alter, und die Versuche, Einbauraten fehlerhafter Aminosäuren in Proteine alternsabhängig zu quantifizieren, erbrachten ebenfalls negative Ergebnisse.
Im Mittelpunkt der Frage nach molekularen Schädigungen und ihrer Reparatur steht die zentrale Rolle von freien Sauerstoffradikalen, die für zahlreiche degenerative Erkrankungen und den Alternsprozeß mit verantwortlich sind. Endogen werden freie Radikale spontan als häufig instabile Zwischen- und Nebenprodukte des normalen aeroben Zellstoffwechsels (besonders in der Atmungskette) gebildet. Die exogenen Quellen sind überaus vielfältig; sie reichen von ionisierenden Strahlen bis zu Tabakrauch (Rauchen) und zahlreichen Nahrungsmittelinhaltsstoffen. Insgesamt führen freie Radikale mit zunehmendem Alter zu einer vermehrten Sauerstoffbelastung. Von diesem oxidativen Streß sind die Mitochondrien in der Zelle besonders betroffen, da in ihnen die Atmungskette abläuft und somit eine lokal relativ hohe Konzentration an freien Radikalen vorliegt. Mitochondriale DNA (Chondrom) hat im Gegensatz zur Kern-DNA (Desoxyribonucleinsäuren) keine funktionslosen Bereiche; ferner fehlen in den Mitochondrien DNA-Reparatursysteme. Bei einer Zellteilung können eventuell beschädigte Mitochondrien ungleichmäßig auf die Tochterzellen verteilt werden und damit den Energiestoffwechsel des entsprechenden Organs empfindlich stören. Verschiedene Messungen ergaben, daß tatsächlich die spezifischen Aktivitäten mitochondrialer Enzyme mit zunehmendem Alter des Untersuchungsobjekts stark abnehmen. Auf zellulärem Niveau macht sich der oxidative Streß in einer Verschiebung des Redoxzustands (Redoxpotential, Redoxreaktionen) zur mehr oxidierten Seite hin bemerkbar. Die Veränderungen im Zellmilieu, die damit entstehen, sind in ihren Einzelheiten noch nicht völlig durchschaubar, dürften aber von größtem Ausmaß für die Stabilität von Zellproteinen (verstärkte intrazelluläre Hydrolyse), allosterische Beeinflussung (Allosterie) von Enzymen und damit für den gesamten Zellstoffwechsel sein. Charakteristisch für eine junge Zelle ist, daß der Gehalt an Antioxidantien und somit auch an freien Radikalen sehr genau reguliert wird. Ein derartig ausbalancierter Pegel von freien Radikalen ist Voraussetzung für ungestörte Entwicklungs- und Zelldifferenzierungsvorgänge, womit die unauflösliche Verquickung von Entwicklung und Altern sehr deutlich zum Ausdruck kommt. Im Alter verändert sich das System von enzymatischen und nicht-enzymatischen Antioxidantien (insbesondere Superoxid-Dismutase, Katalase, Glutathion-Peroxidase; Glutathion) derartig, daß die Aktivität der genannten Enzyme in aller Regel sinkt, der Anteil oxidierten Glutathions (GSSG; γ-Glutamylzyklus) sich erhöht und Substanzen wie Malondialdehyd, Thiobarbitursäure-reaktives Material sowie Lipidperoxide (Lipofuscin) und Wasserstoffperoxid, die alle auf zunehmende Oxidationsprozesse schließen lassen, angehäuft werden. Eine typische Alterns-bezogene Krankheit wie der Morbus Parkinson (Parkinsonsche Krankheit) zeichnet sich durch den Untergang und die Zerstörung von Rezeptorproteinen des dopaminergen Systems in der Substantia nigra des Gehirns aus. In der gleichen Region wird ein stark erniedrigter Glutathiontiter gefunden; somit fehlt auch hier der Oxidationsschutz. Schon lange ist bekannt, daß sich das Protein des Bindegewebes, Kollagen, im Alter verfestigt, was seinerzeit zur Formulierung der Kollagentheorie (cross linking theory) des Alterns geführt hat. Ultraviolettstrahlen ("Sonnenbaden"!) fördern diesen Prozeß (Ultraviolett) und führen zu vorzeitiger Hautalterung (mit der Gefahr der Bildung von bösartigen Melanomen) durch Erhöhung der Radikalbelastung. Durch endogene freie Radikale mitbedingt ist die in den Augen zu beobachtende Sklerose der Linsenproteine (Crystalline), die eine normale Alternserscheinung ist und zur Altersweitsichtigkeit führt. Zunächst kommt es hier – wie auch in anderen Geweben – mit zunehmendem Alter zu Reaktionen zwischen reduzierenden Zuckern und Aminosäuren, in Form einer nichtenzymatischen Glykosylierung. Diese Maillard-Reaktion läuft auch beim Erhitzen oder bei längerer Lagerung von kohlenhydrat- und proteinhaltigen Lebensmitteln ab. Aus den Glykosylierungsprodukten werden dann Ketoamine gebildet, sog. Amadoriprodukte. Weitere spontane Modifikationen der Amadoriprodukte führen zu kovalent verbundenen und gefärbten Endprodukten, die als AGEs (advanced glycation endproducts) bezeichnet werden. Da die endogene Produktion von freien Radikalen von der Stoffwechselintensität abhängt, wurde versucht, aus der Kapazität der Reparaturmechanismen einerseits und der Radikalbildung andererseits eine Determinante für die Lebenslänge abzuleiten. Tatsächlich konnte bei Tieren verschiedener systematischer Zugehörigkeit eine Beziehung zwischen der DNA-Reparaturkapazität und der Lebensdauer nachgewiesen werden; es sind aber auch Ausnahmen von diesem Zusammenhang gefunden worden. Versuche mit pharmakologisch verabreichten Radikalfängern oder exogenen Antioxidantien (z. B. dem in Geriatrika enthaltenen Vitamin E; Tocopherol) ergaben ebenfalls keine durchgehend eindeutigen Ergebnisse. Umgebungstemperatur intensiviert den oxidativen Stoffwechsel und verkürzt die Lebensdauer von poikilothermen Organismen (Poikilothermie). Nahrungsrestriktion verlängert die Lebensspanne von Ratten und verschiedenen Insekten. Ob dies allerdings an eine verminderte Produktion von freien Radikalen – etwa durch eine Reduktion des Energiestoffwechsels – gebunden ist, scheint unklar. In der Regel wird auch nur die mittlere Lebensdauer erhöht, d. h., es werden Schäden, die einen frühen Tod hervorrufen, vermindert, es wird aber nicht die genetisch determinierte maximale Lebensdauer beeinflußt. Neben den erwähnten Veränderungen bei translatierten Genprodukten und posttranslationalen Modifikationen (posttranslationale Proteinmodifikation) in der Zelle (z. B. durch ein verändertes Zellmilieu) muß auch an eine altersabhängige Veränderung des extrazellulären Milieus gedacht werden, die durch gestörte Diffusion von Metaboliten, aber auch Hormonen und Antigenen hervorgerufen wird. Betrachtet man die eingangs erwähnte Abnahme der Adaptationsfähigkeit auf einem höheren Integrationsniveau, so muß für das Altern von Tieren nach Störungen der neuronalen, humoralen Funktionen und Koordinationsmechanismen und solchen innerhalb des Immunsystems gesucht werden. Sieht man allerdings z. B. von einer unpräziseren Temperaturregulation oder Atmungsregulation im Alter ab, zeigen sich gravierende Störungen der neuronalen Koordination beim Menschen nur im Zusammenhang mit Alterskrankheiten, wie der Alzheimerschen Krankheit und der Parkinsonschen Krankheit. Zudem kann Training die Funktionen im kognitiven und psychomotorischen Bereich länger ungestört aufrechterhalten. Aus zahlreichen, zum Teil divergierenden Befunden, insbesondere an Nagetieren und (post mortem) Gehirnproben des Menschen, läßt sich verallgemeinern, daß, je nach Gehirnregion unterschiedlich ausgeprägt, die Konzentrationen der Neurotransmitter Dopamin und Noradrenalin abnehmen. Die Aktivität des spezifischen präsynaptischen Enzyms Cholinacetyl-Transferase (Acetylcholin) sinkt ebenso wie die der Tyrosin-Hydroxylase (Biosynthese der Catecholamine) und der Dopa-Decarboxylase; dagegen erhöht sich die Aktivität der Monoamin-Oxidase B (Monoamin-Oxidasen), die in den Catecholamin-Katabolismus integriert ist. Eine beim alten Menschen häufig zu beobachtende depressive Verstimmung (Depression) wird auf den Mangel an Catecholaminen zurückgeführt.
Zahlreiche hormonelle Veränderungen begleiten den Alternsprozeß oder sind für ihn verantwortlich. Besonders spektakulär ist dies bei dem erwähnten Fortpflanzungstod von Lachsen und australischen Beutelmäusen. In beiden Fällen – bei der australischen Beutelmaus (Antechinus) nur bei den Männchen – stellt die Fortpflanzung einen derartigen Streß dar, daß sie große Mengen an Cortison produzieren. Die hohen Cortisondosen führen voraussagbar zu Geschwüren und zum Zusammenbruch des Immunsystems. Auf diese Weise kommt es zu einer kontrollierten Populationsentwicklung. Auch Tintenfische (Tintenschnecken) unterliegen dem Fortpflanzungstod. Weibchen von Octopus reduzieren ihre Nahrungsaufnahme nach der Eiablage und während der Fürsorgeperiode für die Eier. Entfernt man die hormonhaltigen optischen Drüsen nach dem Laichen, werden das Brutverhalten unterbrochen, die Nahrungsaufnahme wieder aufgenommen und die Lebensspanne drastisch erhöht. Bei einigen Vertretern der Röhrenspinnen löst Kokonbildung eine Lyse des gesamten Verdauungssystems und damit den Tod der Mutter aus. Mit dem so entstandenen Nahrungsbrei werden die jungen Spinnen gefüttert. Im Bereich der humoralen Regulation von Alternsprozessen des Menschen lag das Augenmerk zunächst vornehmlich auf den Geschlechtshormonen (Sexualhormone). Im Gegensatz zu früheren Behauptungen kann beim gesunden männlichen Individuum keine ausgeprägte Abnahme des Plasma-Testosteronspiegels (Testosteron) – wohl aber eine solche von Nebennierenrinden-Androgenen – nachgewiesen werden. Die im Laufe jedes Tages rhythmisch auftretenden Sekretionsschübe des Testosterons verflachen, wie überhaupt die in aller Regel pulsierende Ausschüttung von Hormonen egalisiert wird. Des weiteren verringert sich die Hemmung der Geschlechtshormone auf die Adenohypophyse, so daß luteinisierendes Hormon (LH bzw. ICSH) und follikelstimulierendes Hormon (FSH) vermehrt produziert werden. Im weiblichen Geschlecht vermindert sich die Sekretionsrate von Östrogen im Zusammenhang mit dem Funktionsverlust der Ovarien und leitet damit die Menopause (Menstruation) ein. Der Östrogenmangel im Alter wird auch mitverantwortlich für die gerade bei Frauen verstärkt auftretende Alters-Osteoporose gemacht. Im Calciumstoffwechsel (Calcium) sind weitere Ursachen zu suchen: Selbst bei gesunden Individuen erhöht sich der Serumtiter des Parathormons; möglicherweise wird es verlangsamt abgebaut. Eine Calciumsubstitution ist daher im Alter besonders wichtig, zumal auch der Calcitoninspiegel (Calcitonin) nur langsam nach Erhöhung des Calciums in der Nahrung ansteigt. Eine typische alternsbedingte "Fehlregulation" ist dann zu beobachten, wenn bei vermindertem Calciumangebot (z. B. infolge verschlechterter Resorption) eine Erhöhung des Serumcalciumspiegels dadurch "versucht" wird, daß durch vermehrte Ausschüttung von Parathormon (sekundärer Hyperparathyreoidismus) die Knochen zusätzlich demineralisiert werden. Veränderungen der hormonalen Regulation finden sich auch im Bereich der Pankreashormone (Pankreas) und der Mineralcorticosteroide (Mineralocorticoide, Corticosteroide). Offenbar durch eine verminderte Ansprechbarkeit der Insulinrezeptoren (Insulinrezeptor) bedingt, kommt es zu der bekannten Abnahme der Glucosetoleranz (Glucose) im Alter. Durch die reduzierte Ausschüttung von Aldosteron ist die Homöostase des Elektrolythaushalts und Wasserhaushalts gestört; einem erhöhten Natrium- und Wasserverlust muß daher durch vermehrte Substitution begegnet werden. (Der alte Mensch muß viel trinken und verlangt – auch schon wegen der Abnahme der Empfindlichkeit seiner Geschmacksrezeptoren – nach kräftiger gewürzten Speisen.) Die schwächere Fähigkeit zur Homöostase im Bereich der Osmoregulation macht sich auch dadurch bemerkbar, daß es nach metabolischer Acidose länger dauert, bis die Belastung kompensiert worden ist. Wahrscheinlich spielt eine verminderte Bildung und Sekretion von NH4+-Ionen (Ammonium, Ammoniak) in der Niere dabei eine Rolle. Obwohl die basale Stoffwechselrate im Alter mehr oder weniger stark absinkt, behält entgegen früheren Annahmen die Schilddrüse ihre Sekretion von Thyroxin bis ins hohe Alter adäquat bei. Möglich ist allerdings eine verminderte Ansprechbarkeit der Rezeptoren der Erfolgsorgane.
Das Altern des Immunsystems geht einher mit einer Verlangsamung der Selbstreplikation und Differenzierung der Stammzellen (Blutbildung). Dies hat zur Folge, daß Infektionen erst verzögert mit einer adäquaten Immunantwort bekämpft werden. Auf der Ebene der Makrophagen kann man kaum Alternserscheinungen feststellen; auch B-Zellen (B-Lymphocyten) sind davon wenig betroffen (die Affinität von Antikörpern gegenüber Antigenen nimmt allerdings ab). Die allgemeine Abnahme der Immunfunktion beruht vielmehr hauptsächlich auf Veränderungen in der T-Zellen-Population (T-Lymphocyten). Insbesondere sinkt ihre Proliferationskapazität und damit Klonbildung nach experimenteller Stimulation mit Mitogenen wie Phythämagglutininen (Lectine) und Concanavalin. Daneben spielen Autoimmunprozesse in höherem Alter eine nicht zu unterschätzende Rolle. Es kann ein altersabhängiger Anstieg im Titer von autoanti-idiotypischen Antikörpern und Antikörpern, die mit körpereigenem Gewebe reagieren, beobachtet werden. Zunächst hypothetisch angenommen und inzwischen mehrfach nachgewiesen ist die Vorstellung, daß die quantitative Expression der Autoantikörper oder ihrer Idiotypen (Idiotyp) bei alten Individuen durch Bildung von Idiotyp-Antikörpern reguliert wird (sog. autologe anti-idiotypische Antwort; Netzwerktheorie). Die Vermehrung der so gebildeten Autoanti-Idiotyp-Antikörper im Alter kann zum Teil für die verminderte Ansprechbarkeit des Immunsystems verantwortlich sein; die Ausbildung Antikörper-vermittelter Reaktionen wird somit zunehmend unterdrückt.
Alternsmechanismen pflanzlicher Organismen
Das Altern von Pflanzen wird in der Regel als Seneszenz bezeichnet. Im Gegensatz zur Seneszenz von Tieren handelt es sich hierbei aber nicht um eine allmähliche Akkumulation von Schäden, die die letzte Phase des Alternsprozesses begleiten können (aber nicht müssen), sondern um einen klar zu definierenden Prozeß, der durch ein Seneszenzsignal ausgelöst wird. Bei einer einjährigen Pflanze (Annuelle) folgen in strikter Reihenfolge Keimung des Samens, Heranwachsen zur Adultform und Blüte aufeinander und sofort nach dem Fruchten und erfolgreicher Ausbildung der neuen Samen das Absterben der Pflanze. Greift man experimentell in den Verlauf dieses Programms ein, indem man z. B. das Fruchten durch Abpflücken der Blüten verhindert, so läßt sich die Lebensdauer der Pflanze wesentlich verlängern. Auch der Lebensverlauf mehrjähriger Pflanzen (mehrjährig) unterliegt einem solchen Programm: Das zweijährige Bilsenkraut etwa gelangt nur zur Blütenbildung, wenn es einer Kälteperiode ausgesetzt (vernalisiert; Vernalisation) wurde. Wird es nun im Gewächshaus bei gleichmäßig hoher Temperatur kultiviert, so kann es jahrelang vegetativ weiterwachsen, da das entscheidende Signal zum Altern, das offenbar von den Blüten oder jungen Früchten ausgeht, ausbleibt. Altert und stirbt bei den eben erwähnten hapaxanthen Pflanzen nach erfolgreichem Blühen und Fruchten das gesamte Individuum, so ist bei den pollakanthen Pflanzen der Alternsprozeß auf bestimmte Organe beschränkt (z. B. herbstlicher Blattfall bei sommergrünen Pflanzen). Doch auch bei den langlebigen baumartigen Bedecktsamern und Nacktsamern ist die maximale Lebensdauer des gesamten Organismus recht präzise definiert. Schon die hier zu beobachtenden großen Unterschiede beim maximal erreichbaren Alter der Bäume (beim Mammutbaum bis über 4000 Jahre; Sequoiadendron) stützen die Annahme, daß diese biologische Größe im Genom der Organismen verankert ist. Einige Botaniker zählen die Bäume zu den potentiell unsterblichen Organismen. Mit dem Kambium besitzen diese eine teilungsaktive Zellschicht, die nach außen und innen permanent Zellen abgibt, und an den Spitzen sämtlicher Haupt- und Seitentriebe sowie im Wurzelbereich befinden sich meristematische Zellen. Auch ein mehrere tausend Jahre alter Mammutbaum wächst also noch, und die Nadeln und Früchte, die ein solcher Baum jährlich produziert, gleichen denen junger Bäume und zeigen keine Alternssymptome. Über Stecklinge oder Pfropfreiser lassen sich schließlich wieder "junge" Pflanzen ziehen, deren teilungsfähige Zellagen mit Teilen des alten Baums sozusagen identisch sind. Viele Obstsorten (Obst) werden so seit vielen Jahrhunderten vermehrt (vegetative Vermehrung). Der Tod eines pflanzlichen Individuums ist also nicht unbedingt mit dem Tod des entsprechenden Genotyps gleichzusetzen. Physiologische Symptome alternder Individuen annueller Pflanzen nach Eintritt in die reproduktive Phase zeigen sich unter anderem in einem abnehmenden Protein- und Chlorophyllgehalt der Blätter, einer Lyse von Gewebszellen und einem Wasserverlust. Zum Teil hängt dies mit einer Aufzehrung von Stoffwechselreserven zusammen; Auslöser ist aber eine Verschiebung der Balance von Hormonen. Dabei fördern Abscisinsäure und Ethylen die Seneszenz, wogegen Wachstumshormone wie Auxine, Cytokinine und Gibberelline sie verhindern. – Bei perennierenden Pflanzen (ausdauernd) sind die Seneszenzphänomene insgesamt nicht so ausgeprägt wie bei annuellen. Man beobachtet eine erhöhte Anzahl von Zellen mit chromosomalen Defekten, Defekte in den Leitgefäßen und eine Abnahme der Kambiumtätigkeit durch Mangelernährung des apikalen Meristems. Hormonelle Seneszenzsignale, die in einem definierten Entwicklungsstadium induziert werden, spielen ebenfalls eine Rolle. Für die Blattseneszenz ist ein streng sequentieller Ablauf charakteristisch. Unabhängig davon, ob es zu einem Laubfall kommt oder nicht, wird in allen Pflanzen eine gut ausgeprägte physikalische Barriere zwischen den Zellen des seneszenten Blatts (nach Chlorophyllrückgewinnung) und den grünen funktionsfähigen Zellen des Stengels gebildet. Der Laubfall selbst wird dadurch vorbereitet, daß sich spezifische Ethylen-sensitive Zellen an der Basis der Blätter oder Blattstengel ausdifferenzieren und durch Ethylen aktiviert werden, das vom seneszenten Gewebe distal zu der präformierten Stelle gebildet wird. Als Reaktion auf diesen hormonalen Reiz synthetisieren und sezernieren die Empfängerzellen Polysaccharid-spaltende Enzyme, die die Mittellamelle zwischen ihnen und der "Bruchstelle" auflösen. Der Abwurf des seneszenten Blatts ist somit ein aktiver Prozeß. Auch das Reifen von Früchten kann als Seneszenz betrachtet werden. Es ist durch steigende Aktivitäten katabolischer Enzyme und damit einen Anstieg der Synthese von RNAsen sowie durch hydrolytische Prozesse, die z. B. zur Umwandlung von Stärke und zur Auflösung von Zellwänden und Biomembranen führen, gekennzeichnet. – Die Seneszenz auf zellulärer Ebene ist – ebenso wie bei der tierischen Zelle – an Differenzierungsprozesse gebunden. Verhindert man experimentell die Differenzierung (Erhalt der Totipotenz; Omnipotenz), altern die Zellen nicht (vgl. Krebszellen). Das Altern von Pflanzenzellen im Zellverband wird durch umliegende Zellen im Sinne eines organisierten Zelltodes (Tod) ausgelöst (z. B. Bildung von Steinzellen, Tracheen im Xylem), ist also ebenfalls Teil eines Entwicklungsprogramms. In alternden Keimblättern konnte ein Verlust der Integrität von Kern-DNA über einen Anstieg der Produkte von Einzelstrangbrüchen nachgewiesen werden (zunehmender Verlust der Template-Funktionen).
Altern beim Menschen
Eine ganze Palette von diagnostischen Parametern, die mit dem Altern beim Menschen einhergehen, sind allgemein geläufig. So zielt etwa die alte Volksweisheit, daß der Mensch so alt sei wie seine Arterien, auf die Tatsache hin, daß mit fortschreitendem Altern die Schlagadern durch Ablagerungen von Fett (Lipoproteine) und Kalk starr und spröde werden. Die daraus resultierende Arteriosklerose führt schließlich irreversibel zum Altern und Tod. Auch Organe mit nicht mehr teilungsfähigen Zellen und solche Organe, die von außen nach innen wachsen und den Ausfall zentraler Strukturen nicht ersetzen können, erleiden sukzessive Dauerveränderungen (z. B. Rippenknorpel, Augenlinse). Allgemein nehmen die voll funktionstüchtigen G
Veränderung der Lebenserwartung des Menschen
Kann man auch annehmen, daß sich die MLP (potentielle maximale Lebensspanne) seit dem Auftauchen des Homo sapiens nicht wesentlich verändert hat, so sieht dies bei der Lebenserwartung völlig anders aus. Es ist allgemein bekannt, daß sich die Lebenserwartung des Menschen in den Industriestaaten seit der Mitte des 19. Jahrhunderts in vorher nicht gekanntem Tempo erhöht hat, was praktisch zu ihrer Verdoppelung von etwa 40 auf 80 Jahre geführt hat. So liegt die Frage nahe, ob und wie sich dieser Prozeß fortführen läßt und welche Konsequenzen sich daraus ergeben. Hierzu sind Überlegungen und Zahlen interessant, wie sie kürzlich in der Zeitschrift "Science" veröffentlicht wurden. Der entscheidende Schritt zum Anstieg der Lebenserwartung wurde durch die Senkung der Mütter- und Säuglingssterblichkeit erreicht. Derzeit sterben etwa 12,4% der Bevölkerung vor dem 50. Lebensjahr (alle Werte für die USA). Würde es gelingen, diesen Anteil auf Null zu reduzieren, wäre damit ein Anstieg der Lebenserwartung bei der Geburt um lediglich 3,5 Jahre erreicht.
Die Anstrengungen müssen sich daher offenbar auf diejenigen Krankheiten im Alter konzentrieren, die für eine Erhöhung der Sterberate jenseits der Lebensmitte verantwortlich sind. Dabei kann es nicht darauf ankommen, eine Lebensverlängerung mit einer verlängerten Phase in abhängigem und krankem Zustand zu erkaufen, vielmehr gilt es, die "aktive Lebenserwartung" zu erhöhen. Im Jahre 1900 lag die Lebenserwartung bei der Geburt bei 47 Jahren und ist seitdem auf etwa 75 Jahre gestiegen. Bis zum Jahre 1990 lag das längste sicher dokumentierte Alter eines Menschen bei 120 Jahren. Allein aus dieser genetisch determinierten Grenze läßt sich mit Blick auf die dargestellte Mortalitätscharakteristik ablesen, daß ohne eine rein spekulative Möglichkeit der genetischen Manipulation nur noch bescheidene Fortschritte in der weiteren Verlängerung der Lebenserwartung im 50. Lebensjahr zu erzielen sein werden. Es läßt sich abschätzen, daß allein eine Erhöhung der Lebenserwartung bei der Geburt auf 80 Jahre die Senkung der Mortalität bei Frauen um weitere 12%, bei Männern, die eine geringere Lebenserwartung besitzen, bereits um 48% bedeuten würde. Stiege die Lebenserwartung auf 85 Jahre (was derzeit als biologische Grenze angesehen wird), hieße das eine Reduktion der Mortalität über die gesamte Lebensspanne von 43% bei Frauen und 65% bei Männern; für 105 Jahre Lebenserwartung ergäbe sich schon eine Senkung der Mortalität um über 90% über dem bisherigen Wert.
Gemessen an den realen Möglichkeiten der Elimination von Krankheiten kann man folgern, daß bei Ausschaltung aller Kreislauferkrankungen, Krebs und Diabetes die Lebenserwartung eines 50-Jährigen, die derzeit für Frauen bei 30 Jahren liegt, um knapp 15 Jahre steigen würde. Zu erreichen wäre dies nur über eine Reduktion der Mortalitätsrate um etwa 75% über das Maß hinaus, das für den Anteil der Population (im Jahre 1985) gemessen wurde, der älter als 50 Jahre war. Auch die Lebenserwartung der Neugeborenen würde sich kaum von den so ermittelten Werten unterscheiden, da mehr als 94% der angesprochenen Krankheiten nach dem 50. Lebensjahr auftreten.
Eine zentrale und bisher unbeantwortete Frage ist, ob bei allem Erfolg, die Mortalität zu reduzieren und damit die Lebenserwartung zu erhöhen, auch die Morbidität des alten Menschen verschoben und auf einen engeren Zeitraum beschränkt werden kann. Andernfalls wäre das Ergebnis der Beseitigung lebensbedrohender Krankheiten eine wachsende Anzahl von alten Menschen, die unter Alternsbeschwerden wie Osteoporose, Arthritis, Morbus Parkinson und seniler Demenz wie der Alzheimerschen Krankheit leiden – Krankheiten, die per se die Lebenserwartung nicht wesentlich beeinflussen, aber die gewonnenen Jahre nicht lebenswert erscheinen lassen. Im Falle der rapiden Zunahme der Alzheimerschen Demenz deutet sich diese Entwicklung bereits unübersehbar an.
|
Warum leben Frauen im Durchschnitt länger als Männer?
Die Antwort kann auf der phylogenetischen (soziobiologischen) und der physiologischen Ebene versucht werden:
Unter dem bereits erwähnten Aspekt der Fitnessmaximierung befinden sich die beiden Geschlechter ursprünglich in einer unterschiedlichen Situation. Für das männliche Geschlecht ist es günstig, die Gene möglichst weit zu streuen, d. h., möglichst viele Geschlechtspartner zu besitzen. Der Aufwand hierzu erfordert einen erheblichen physiologischen Streß, der sich lebensverkürzend auswirkt. Wegen der großen Investition in die Nachkommen und des Risikos, das mit dem Kinderkriegen verbunden ist, kommt es im weiblichen Geschlecht darauf an, die Geborenen zu schützen und dafür zu sorgen, daß sie selber wieder Kinder bekommen können. Dies ist die Aufgabe der "Großmutter". Ihre Gene sind bei den Enkeln besser gesichert, als wenn sie selber noch in hohem Alter Kinder bekommen würden.
Unter dem physiologischen Aspekt wird eine Reihe von Faktoren diskutiert. Man weiß, daß das weibliche Geschlecht in Bezug auf die Lipoproteine gegenüber dem männlichen Geschlecht begünstigt ist. Der Grund hierfür liegt in der unterschiedlichen hormonellen Konstitution der Frauen. Frauen haben im allgemeinen mehr HDL-Lipoproteine (high density lipoproteins) als Männer. Da der Cholesterinanteil der LDL (Cholesterin, low density lipoproteins) eine wichtige Rolle z. B. für den Ausbruch von Koronarerkrankungen (Herzinfarkt) und Arteriosklerose spielt, kann man schließen, daß die Risiken für Frauen, an einem dieser Leiden zu erkranken, geringer sind. Möglicherweise sind aber auch die Geschlechtschromosomen mitverantwortlich für die unterschiedliche Lebensdauer: Frauen haben im Gegensatz zu Männern zwei X-Chromosomen (X-Chromosom). Während der Embryogenese wird aber ein X-Chromosom inaktiviert (X-Inaktivierung), d. h., im Endeffekt besitzen Frauen ebenfalls nur ein aktives X-Chromosom. Dabei ist es Zufall, welches der X-Chromosomen inaktiviert wird, so daß es Zellen mit einem männlichen und solche mit einem weiblichen X-Chromosom gibt. Wenn nun ein X-Chromosom-gebundener Gendefekt vorliegt, kann er von Frauen besser kompensiert werden als von Männern. Es gibt Erbkrankheiten, von denen insbesondere Männer betroffen sind, z. B. die Duchenne-Muskeldystrophie (Myopathie). Andererseits werden bestimmte Enzyme von Genen, die an das X-Chromosom gebunden sind, gebildet, z. B. DNA-Polymerasen. Sie sind wichtig für die DNA-Replikation, aber auch an der Reparatur von DNA-Schäden (DNA-Reparatur) beteiligt. Bei den DNA-Polymerasen gibt es Gendefekte, die sich in einer verminderten Bildungsrate der Enzyme bemerkbar machen. Frauen haben die Chance, einen solchen Gendefekt, der sich direkt an der DNA manifestiert, besser zu kompensieren. Zumindest bei weiblichen Mäusen konnte nachgewiesen werden, daß das zweite (inaktivierte) X-Chromosom mit zunehmendem Alter wieder reaktiviert wird. Das hat Vor- und Nachteile. Die Reaktivierung im Alter kann neue genetische Information zur Verfügung stellen. Dies kann von Vorteil sein, wenn z. B. die Bildung der DNA-Polymerasen auf diese Weise wieder verbessert wird. Es kann aber auch durchaus negativ sein, wenn nämlich Gendefekte, die vorher auf dem inaktivierten X-Chromosom vorhanden waren, nun durch die Reaktivierung zum Tragen kommen.
Veränderung der Lebenserwartung des Menschen
Kann man auch annehmen, daß sich die MLP (potentielle maximale Lebensspanne) seit dem Auftauchen des Homo sapiens nicht wesentlich verändert hat, so sieht dies bei der Lebenserwartung völlig anders aus. Es ist allgemein bekannt, daß sich die Lebenserwartung des Menschen in den Industriestaaten seit der Mitte des 19. Jahrhunderts in vorher nicht gekanntem Tempo erhöht hat, was praktisch zu ihrer Verdoppelung von etwa 40 auf 80 Jahre geführt hat. So liegt die Frage nahe, ob und wie sich dieser Prozeß fortführen läßt und welche Konsequenzen sich daraus ergeben. Hierzu sind Überlegungen und Zahlen interessant, wie sie kürzlich in der Zeitschrift "Science" veröffentlicht wurden. Der entscheidende Schritt zum Anstieg der Lebenserwartung wurde durch die Senkung der Mütter- und Säuglingssterblichkeit erreicht. Derzeit sterben etwa 12,4% der Bevölkerung vor dem 50. Lebensjahr (alle Werte für die USA). Würde es gelingen, diesen Anteil auf Null zu reduzieren, wäre damit ein Anstieg der Lebenserwartung bei der Geburt um lediglich 3,5 Jahre erreicht.
Die Anstrengungen müssen sich daher offenbar auf diejenigen Krankheiten im Alter konzentrieren, die für eine Erhöhung der Sterberate jenseits der Lebensmitte verantwortlich sind. Dabei kann es nicht darauf ankommen, eine Lebensverlängerung mit einer verlängerten Phase in abhängigem und krankem Zustand zu erkaufen, vielmehr gilt es, die "aktive Lebenserwartung" zu erhöhen. Im Jahre 1900 lag die Lebenserwartung bei der Geburt bei 47 Jahren und ist seitdem auf etwa 75 Jahre gestiegen. Bis zum Jahre 1990 lag das längste sicher dokumentierte Alter eines Menschen bei 120 Jahren. Allein aus dieser genetisch determinierten Grenze läßt sich mit Blick auf die dargestellte Mortalitätscharakteristik ablesen, daß ohne eine rein spekulative Möglichkeit der genetischen Manipulation nur noch bescheidene Fortschritte in der weiteren Verlängerung der Lebenserwartung im 50. Lebensjahr zu erzielen sein werden. Es läßt sich abschätzen, daß allein eine Erhöhung der Lebenserwartung bei der Geburt auf 80 Jahre die Senkung der Mortalität bei Frauen um weitere 12%, bei Männern, die eine geringere Lebenserwartung besitzen, bereits um 48% bedeuten würde. Stiege die Lebenserwartung auf 85 Jahre (was derzeit als biologische Grenze angesehen wird), hieße das eine Reduktion der Mortalität über die gesamte Lebensspanne von 43% bei Frauen und 65% bei Männern; für 105 Jahre Lebenserwartung ergäbe sich schon eine Senkung der Mortalität um über 90% über dem bisherigen Wert.
Gemessen an den realen Möglichkeiten der Elimination von Krankheiten kann man folgern, daß bei Ausschaltung aller Kreislauferkrankungen, Krebs und Diabetes die Lebenserwartung eines 50-Jährigen, die derzeit für Frauen bei 30 Jahren liegt, um knapp 15 Jahre steigen würde. Zu erreichen wäre dies nur über eine Reduktion der Mortalitätsrate um etwa 75% über das Maß hinaus, das für den Anteil der Population (im Jahre 1985) gemessen wurde, der älter als 50 Jahre war. Auch die Lebenserwartung der Neugeborenen würde sich kaum von den so ermittelten Werten unterscheiden, da mehr als 94% der angesprochenen Krankheiten nach dem 50. Lebensjahr auftreten.
Eine zentrale und bisher unbeantwortete Frage ist, ob bei allem Erfolg, die Mortalität zu reduzieren und damit die Lebenserwartung zu erhöhen, auch die Morbidität des alten Menschen verschoben und auf einen engeren Zeitraum beschränkt werden kann. Andernfalls wäre das Ergebnis der Beseitigung lebensbedrohender Krankheiten eine wachsende Anzahl von alten Menschen, die unter Alternsbeschwerden wie Osteoporose, Arthritis, Morbus Parkinson und seniler Demenz wie der Alzheimerschen Krankheit leiden – Krankheiten, die per se die Lebenserwartung nicht wesentlich beeinflussen, aber die gewonnenen Jahre nicht lebenswert erscheinen lassen. Im Falle der rapiden Zunahme der Alzheimerschen Demenz deutet sich diese Entwicklung bereits unübersehbar an.
|
|
Schreiben Sie uns!