Lexikon der Biologie: Calciumkanäle
Calciumkanäle, spannungsabhängige Calciumkanäle, transmembranäre Glykoproteine, deren wäßrige Poren spannungsabhängig, nach Depolarisation der Zell-Membran, öffnen und für Ca2+ (Calcium), aber auch für andere divalente Kationen, wie Ba2+ und Sr2+, permeabel sind. Ni2+ (Nickel), Co2+ (Kobalt) oder Cd2+ (Cadmium) hingegen können Ca2+-Kanäle blockieren. Ca2+-KanalMakromoleküle (relative Molekülmasse ca. 447 000) bestehen aus mehreren Proteinuntereinheiten (α1, α2, β, γ und δ). Die α1-Untereinheit ist die wichtigste: sie bildet die Calcium-permeable Pore und besitzt den Spannungsfühler, der als Antwort auf Depolarisationen zur Konformationsänderung mit Öffnung des Kanals führt (ävgl. Abb.). Es gibt mehrere Typen von Calciumkanälen (mindestens 6 Gene für unterschiedliche α1-Untereinheiten: α1S, α1A, α1B, α1C, α1D, α1E). Diese genetische Vielfalt spiegelt sich auch in den funktionellen Eigenschaften wider. Ein auffallendes Unterscheidungsmerkmal zwischen den Kanaltypen ist ihre unterschiedliche Sensitivität gegenüber Membranpotentialveränderungen. Einige aktivieren bereits nach kleinen Depolarisationen (LVA-Kanäle, von low voltage-activated), während andere starke Depolarisationen benötigen (HVA-Kanäle, von high voltage-activated). Weitere Differenzierungsmöglichkeiten ergeben sich in Bezug auf ihre Leitfähigkeit für Ca2+, ihre Inaktivierungskinetik und ihre Pharmakologie ( ä vgl. Infobox ). – Öffnen von Ca2+-Kanälen führt zum Einstrom von Ca2+ in die Zellen. Dies kommt daher, daß die Ca2+-Konzentration im Intrazellularraum niedriger als im Extrazellularraum ist (z. B. Skelettmuskel: 1,5 mM Ca2+ extra- und 0,1 mM Ca2+ intrazellulär). Das intrazelluläre Ca2+ wird nämlich unter Ruhebedingungen – Ca2+-Kanäle sind geschlossen – durch aktiven Transport über die Zellmembran (ATP-abhängige Pumpen, Na+/Ca2+-Austauscher) und durch Transport in intrazelluläre Organellen, wie endoplasmatisches und sarkoplasmatisches Reticulum, niedrig gehalten. – Ca2+-Kanäle können in erregbaren Zellen zwei grundsätzliche Funktionen ausüben: einerseits sind sie an den elektrischen Vorgängen der Erregungsbildung (Erregung, Erregungsleitung) direkt beteiligt (elektrogene Funktion), andererseits stellen sie aber auch das wichtigste Verbindungsglied zwischen Erregung (Depolarisation) und spezifischen Zelleistungen dar (regulatorische Funktion). Elektrogene Funktion: In den Glattmuskelzellen z. B. der Blutgefäße fehlen funktionelle Na+-Kanäle (Natriumkanäle), d. h., Aktionspotentiale (und somit die Erregungsausbreitung) sind hier ausschließlich durch Ca2+-Kanäle getragen (Ca2+-Spikes). Regulatorische Funktionen: Die Neurotransmitterfreisetzung (Neurotransmitter) aus Nervenendigungen wird durch ein Ansteigen des intrazellulären Ca2+ ausgelöst (Stimulus-Sekretions-Kopplung). Dies geschieht dann, wenn ein Aktionspotential an einer präsynaptischen Nervenendigung zur Depolarisation und zum Öffnen von spannungsabhängigen Ca2+-Kanälen führt. Als intrazelluläre Ca2+-Sensoren werden dabei Proteine wie das Synaptophysin und das Synaptotagmin (regulierte Exocytose) diskutiert. Beide können Ca2+ binden, wobei letzteres ein Protein der transmitterhaltigen, synaptischen Speichervesikel ist. Letztlich kommt es zum Verschmelzen der Vesikelmembran mit der Plasmamembran der Nervenendigung, der Transmitter wird in den synaptischen Spalt (Synapsen) freigesetzt. Der Prozeß wird beendet, wenn das intrazelluläre Ca2+ durch obengenannte Mechanismen wieder abgesenkt wird. Ein weiteres Beispiel für die regulatorische Rolle von Ca2+ ist die Auslösung von Muskelkontraktionen (sogenannten Excitations-Kontraktions-Kopplung): Im Muskel ist Ca2+ im sarkoplasmatischen Reticulum gespeichert. Die Zisternen des sarkoplasmatischen Reticulums stehen dabei in engem Kontakt mit Invaginationen der Zellmembran, den transversalen Tubuli (T-Tubuli). Wird die Muskelmembran depolarisiert, pflanzt sich die Erregung über die T-Tubuli in die Tiefe der Muskelfaser fort und öffnet an den Kontaktstellen zwischen T-System und sarkoplasmatischem Reticulum Ca2+-Kanäle (Ryanodinrezeptor-Kanäle; benannt nach ihrer Fähigkeit, das Pflanzenalkaloid Ryanodin zu binden; Inositol-1,4,5-triphosphatrezeptor). Durch diese Kanäle strömt Ca2+ in das Cytoplasma. Der Anstieg der intrazellulären Konzentration an freiem Ca2+ führt dann zur allosterischen Umlagerung (Allosterie) von Troponin-Tropomyosin-Komplexen an den Actinfilamenten und ermöglicht über das Binden von Myosinköpfen (Myosin) am Actin die Kontraktion. Calcium-Promotoren, Ionenkanäle.
W.N.
| |
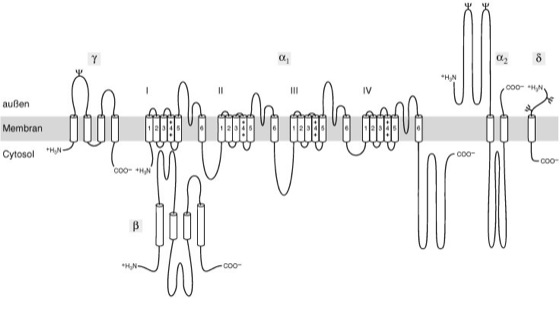
| Calciumkanäle Theoretische transmembranäre Struktur des spannungsabhängigen Calciumkanals und funktionelle Bedeutung der Untereinheiten. Ca2+-Kanäle des Skelettmuskels sind Proteinkomplexe, die aus jeweils einer α1-, α2-, β-, γ- und δ-Untereinheit zusammengesetzt sind. Die α1-Untereinheit weist vier transmembranäre Domänen (I–IV) auf, die aus jeweils sechs α-helikalen Strukturen (1–6) zusammengesetzt sind, α2, γ und δ besitzen jeweils ein transmembranäres Segment. Dieses wird im Fall von α2 aus zwei, bei γ aus vier und bei δ aus einer α-Helix gebildet. Die β-Untereinheit wird nicht glykosyliert, und man nimmt daher an, daß sie intrazellulär lokalisiert ist. In der Abbildung stellen Zylinder die α-helikalen Segmente dar. Durchgezogene Linien stehen für die Polypeptidketten jeder Untereinheit mit einer Länge, die etwa proportional zur Anzahl der Aminosäuren ist. ψ bezeichnet Glykosylierungsstellen. Exprimiert man RNA nur für die α1-Untereinheit in Xenopus-Oocyten, so bilden diese Zellen funktionierende Ca2+-Kanäle. Die α1-Untereinheit ist also die Hauptstruktur des Komplexes und enthält die Ca2+-selektive Pore sowie den Spannungsfühler des Proteins. Man geht gegenwärtig davon aus, daß der Meßfühler für die Potentialänderung in Helix 4 jeder der vier transmembranären Domänen der α1-Untereinheit lokalisiert ist. Als Mechanismus wird angenommen, daß sich beim Öffnen des Kanals hier an das Protein gebundene positive Ladungen von der cytosolischen zur extrazellulären Seite der Membran bewegen. Die durch Änderung des elektrischen Feldes ausgelöste Verschiebung dieser Ladungen (gating charges) führt dann über eine Konformationsänderung des Kanalmoleküls zum Öffnen der Calciumpore. Somit weist die α1-Untereinheit des Ca2+-Kanals eine enge strukturelle Verwandtschaft mit der α-Untereinheit des Na+-Kanals auf (Natriumkanäle). Allerdings haben auch die restlichen Untereinheiten einen Einfluß auf die Funktion des Kanalmoleküls. Wird RNA für α1 zusammen mit α2, β oder γ in Oocyten exprimiert, können sich Spannungsabhängigkeit und zeitlicher Verlauf der Ca2+-Ströme verändern. Allerdings hängt dies von der Herkunft der RNA ab und hat sich bisher nur für cardiale Ca2+-Kanäle eindeutig nachweisen lassen. Anders als diese variablen Ergebnisse scheint der Einfluß der intrazellulären β-Untereinheit auf alle α1-Isoformen, die bisher untersucht wurden, gesichert. Co-Expression von α1 und β führt zu einer Vergrößerung der Leitfähigkeit, Beschleunigung der Aktivierung und zu einer Verschiebung der Aktivierungsschwelle zu negativeren Membranpotentialen. Da β-Untereinheiten ein Substrat zur Phosphorylierung durch zahlreiche Proteinkinasen darstellen und außerdem bekannt ist, daß Phosphorylierung einen Einfluß sowohl auf die Anzahl aktiver Ca2+-Kanäle als auch auf ihre Inaktivierung hat, nimmt man an, daß diese regulatorischen Einflüsse der β-Untereinheiten von Phosphorylierungsmechanismen abhängen. |
Schreiben Sie uns!