Lexikon der Biologie: Insulin
Insulins [von latein. insula = Insel, bezogen auf die Langerhansschen Inseln], Peptidhormon der Wirbeltiere (51 Aminosäuren, relative Molekülmasse 5700–5800) aus den β-Zellen (Beta-Zellen) der Langerhansschen Inseln der Bauchspeicheldrüse (Pankreas). 1869 entdeckte P. Langerhans die nach ihm benannten Insulin produzierenden Zellgruppen im Pankreas, 1921 wurde Insulin von F.G. Banting und C.H. Best isoliert, 1926 gelang J.J. Abel die Reindarstellung und Kristallisation, 1953 wurde es von F. Sanger als erstes Protein sequenziert, und 1969 ermittelte D.M. Hodgkin schließlich die Raumstruktur des Insulins durch Röntgenstrukturanalyse. – Insulin ( vgl. Abb. 1 ) besteht aus 2 Peptidketten, der A-Kette mit 21 und der B-Kette mit 30 Aminosäuren. Beide Ketten werden durch 2 sog. interchenare Disulfidbindungen zu einem bizyklischen System verknüpft, während in der A-Kette eine intrachenare Disulfidbindung enthalten ist. Insulin senkt als Gegenspieler des Glucagons je nach physiologischem Bedarf den Blutglucosespiegel (Blutzucker, Glucose), bei Insulinmangel entsteht das Krankheitsbild des Diabetes mellitus. Die meisten Organismenarten besitzen nur 1 Insulintyp, jedoch konnte gezeigt werden, daß bei einigen Organismen, z.B. Ratte, Maus, Spitzmaus, Thunfisch und Krötenfisch, 2 verschiedene Insulingene bzw. deren Produkte vorliegen. Neben dem Humaninsulin-Gen wurden auch die Insulin-Gene vieler anderer Organismen inzwischen sequenziert. Das reife mRNA-Transkript des Menschen codiert für ein aus 100 Aminosäuren bestehendes Prä-Proinsulin (Prä-Pro-Proteine), das eine aminoterminale hydrophobe, 16 Reste umfassende Signalsequenz trägt. Sobald Prä-Proinsulin – noch während des Translationsvorgangs (Translation) – durch die Membran in das Lumen des endoplasmatischen Reticulums dnitt, wird die Signalsequenz (der Prä-Peptidanteil) entfernt, und es entsteht Proinsulin ( vgl. Abb. 2 ). Proinsulin wird zum Golgi-Apparat transportiert, wo die proteolytische Entfernung einer internen Sequenz, des Verbindungspeptids (connection peptide, C-Peptid), beginnt. In den Speichergranula wird dieser Vorgang fortgesetzt. Im C-Peptid verschiedener Arten konnten Srukturhomologien (Arg–Arg am Aminoende, Lys–Arg am Carboxylende) nachgewiesen werden, welche die proteolytischen Spaltungsstellen für den Angriff durch trypsinähnliche Enzyme darstellen. Die 3 Disulfidbindungen werden unmittelbar nach der Translation gebildet und sind im Proinsulin vorhanden. Die Speicherung des Insulins erfolgt als hexameres Zink-Insulin (6 Insulinmoleküle, 2 Zinkionen) in mikrokristalliner Form in Speichergranula (β-Granula). Durch Fusion der Membran reifer Speichergranula mit der Plasmamembran der Zelle wird das Insulin freigesetzt (Sekretion). Die Insulinausschüttung wird durch eine Konzentrationserhöhung von freien Ca2+-Ionen (Calcium) im Cytoplasma infolge vermehrten Einströmens von Ca2+ durch spannungsabhängige Calciumkanäle und Mobilisierung intrazellulärer Ca2+-Speicher ausgelöst. Die Menge abgegebenen Insulins wird dabei durch das vegetative Nervensystem moduliert. Die Plasmahalbwertszeit von Insulin beträgt weniger als 10 Minuten, jedoch ist die Wirkungsdauer länger, da die Halbwertszeit des an den Insulinrezeptor gebundenen Anteils bei etwa 40 Minuten liegt. Der Hauptabbauort des Insulins ist die Leber. Insulin wird durch rezeptorvermittelte Endocytose in die Leberzellen aufgenommen. Nach der Dissoziation vom Rezeptor greift eine Insulin-Protease sowohl das Insulinmolekül als auch die getrennten A- und B-Ketten, die durch die Wirkung einer membrangebundenen Insulin-Glutathion-Transhydrogenase entstanden sind, an. Wichtigster physiologischer Stimulus für die Insulinsekretion ist eine hohe Blutglucosekonzentration. Die Freisetzung beginnt, sobald der Blutzuckerspiegel den Normalwert überschreitet (die β-Zellen sind hochempfindlich für geringfügige Änderungen der Glucosekonzentration im Blut). Über welchen molekularen Mechanismus Glucose die Insulinsekretion beeinflußt, ist noch ungeklärt. Diskutiert wird, daß Glucose entweder über einen spezifischen Glucoserezeptor oder über Intermediärprodukte des Glucosestoffwechsels die Insulinsekretion stimuliert. Auch die Biosynthese von Insulin ist an die Glucosekonzentrationen gekoppelt. So wird die Insulinsynthese durch Glucosekonzentrationen angeregt, die höher als 2–4 mM sind, während zur Insulinsekretion Glucosekonzentrationen oberhalb von 4–6 mM erforderlich sind. Weitere primäre physiologische Stimuli der Insulinsekretion sind Mannose, Leucin, Arginin, Lysin, kurzkettige und langkettige Fettsäuren, Acetoacetat und β-Hydroxybutyrat (β-Hydroxybuttersäure; Ketonkörper). Zu den sekundären physiologischen Stimuli (fördern die Insulinfreisetzung nicht direkt, beeinflussen jedoch die Antwort auf die primären Stimuli) zählen Glucagon, Sekretin, Pankreozymin (Cholecystokinin), Gastrin, Acetylcholin und Prostaglandin E1 und E2. Von besonderer Bedeutung für die Insulinsekretion ist auch das gastrische inhibitorische Peptid (GiP; gastrointestinale Hormone), dessen Serumkonzentration nach kohlenhydratreichen Mahlzeiten auf Werte ansteigt, welche die Insulinsekretion deutlich stimulieren. Die Biosynthese von Insulin wird außerdem gefördert von Mannose, Dihydroxyaceton, Glycerinaldehyd, Leucin, α-Ketoisocaproat, N-Acetylglucosamin, Glucagon und Methylxanthin-Derivaten. Sulfonylharnstoff-Derivate, die im Fall des Typ-2-Diabetes (mangelhafte sekretorische Antwort der B-Zellen) zur pharmakologischen Anregung der Insulinsekretion angewandt werden, haben keinen steigernden Effekt auf die Insulinbiosynthese. Therapeutisch genutzter Hemmer bei Insulinüberproduktion (Hyperinsulinismus), z.B. bei β-Zellen-Tumor, ist das Diazoxid, das Kaliumkanäle öffnet und dadurch eine Depolarisation der Inselzellen und eine damit verbundene Unterdrückung der Insulinfreisetzung herbeiführt. Eine Reihe von Hormonen wirkt regulierend auf die Insulinfreisetzung. Noradrenalin und Adrenalin hemmen die Insulinsekretion über α-Rezeptoren. Auch das u.a. in den D-Zellen der Langerhansschen Inseln produzierte Somatostatin hemmt die Insulinsekretion. Insulinmangel bewirkt eine Erhöhung des Blutzuckerspiegels und eine vermehrte Abgabe energiereicher Brennstoffe aus dem Aminosäure- und Fettstoffwechsel ins Blut. Die dabei entstehende Übersäuerung (Ketoacidose) kann im Verlauf des diabetischen Komas einen tödlichen Ausgang nehmen (Diabetes mellitus).
Insulin wirkt nicht über das cAMP-System (cAMP), sondern fördert den Einstrom von Ca2+-Ionen in die Zelle und setzt so die Bildung des „second messengers“ (sekundäre Boten) cGMP in Gang. Insulin wirkt als Antagonist des Glucagons blutzuckersenkend, indem es die Durchlässigkeit der Zellmembran für Glucose erhöht und so den Zuckereinstrom ins Gewebe fördert. Gleichzeitig wird die Ausschüttung des Glucagons aus den α-Zellen (A-Zellen) vermindert. Zu den insulinempfindlichen Geweben gehören vor allem die Muskulatur, das Fettgewebe und die Leber. Durch Insulin wird die Glucoseaufnahme der Skelettmuskulatur und des Fettgewebes stimuliert. Durch diese gesteigerte Glucoseverwertung kommt es zu einem raschen Blutglucoseabfall nach Insulingaben. Für die Glucoseaufnahme ist ein Glucosetransportsystem (Glucose-Translokatoren) ausgebildet, das darauf beruht, daß Carriermoleküle (Carrier) in die Plasmamembran verlagert werden und so die Kapazität des Glucosetransports erhöht wird. Über dieses insulinabhängige Glucosetransportsystem verfügt die Leberzelle nicht; von der Leber wird Glucose in Abhängigkeit von der extrazellulären Konzentration aufgenommen. Die vermehrte Glucoseaufnahme hat in den Zielorganen eine Reihe charakteristischer Stoffwechseleffekte zur Folge. In der Muskelzelle kommt es zu einer Zunahme der Glykogensynthese (Glykogen) und zu einer gesteigerten Glykolyse. In der Fettzelle wird die vermehrt aufgenommene Glucose im Pentosephosphatzyklus unter Bildung von NADPH abgebaut. Auch die Glykolyse wird stimuliert; das dabei anfallende Pyruvat (Brenztraubensäure) wird zu Acetyl-Coenzym A decarboxyliert und für die Biosynthese von Fettsäuren verwendet (daher stimuliert Insulin in der Fettzelle die Synthese und Speicherung von Tri-Acylglycerinen). Durch diese Stoffwechselumstellungen kommt es auch zu Veränderungen von Enzymaktivitäten (Enzyme). In der Muskelzelle werden die Glykogen-Synthase und Phosphofructokinase aktiviert; für die Fettzelle ist die Aktivierung der Pyruvat-Dehydrogenase, der Acetyl-Coenzym-A-Carboxylase und der Glycerophosphat-Acyl-Transferase charakteristisch. In der Leber induziert Insulin die Glykolyseenzyme Glucokinase, Phosphofructokinase und Pyruvat-Kinase; daneben hemmt Insulin die Synthese der Enzyme der Gluconeogenese (Phosphoenolpyruvat-Carboxykinase, Fructose-1,6-bisphosphatase, Glucose-6-phosphatase, Pyruvat-Carboxylase). Diese Veränderungen in der Leberzelle gehen mit einer durch Insulin verursachten Senkung des cAMP-Spiegels einher. Insulin hemmt dabei die Adenylat-Cyclase und stimuliert die Phosphodiesterase, die für den Abbau von cAMP verantwortlich ist. Ein ähnlicher Hemmeffekt läßt sich auch am Fettgewebe, nicht aber an der Muskulatur zeigen. Die beschriebenen Wirkungen auf den Stoffwechsel zeigen, daß Insulin das wichtigste anabolisch wirksame Hormon ist. – Die Insuline der verschiedenen Tiergruppen unterscheiden sich nur geringfügig voneinander; die Wirkung ist identisch. Daher wurde therapeutisch benötigtes Insulin lange Zeit industriell durch Extraktion von Bauchspeicheldrüsen aus Schwein und Rind gewonnen. 1978 gelang es, das Insulin-Gen der Ratte in ein Bakteriengenom einzubauen und dort zur Expression zu bringen, seit 1980 wird Humaninsulin mittels gentechnischer Methoden (Gentechnologie, Gen-Medikament) in industriellem Maßstab produziert. Der hohe Bedarf an Insulin (der Weltjahresbedarf beträgt gegenwärtig [Jahr 2000] ca. 6 Tonnen mit einem Marktwert von ca. 1,8 Milliarden DM) läßt sich heute durch die gentechnische Produktion problemlos decken. Andere Herstellungsmethoden, etwa die Semisynthese von Humaninsulin aus Schweineinsulin durch enzymatischen Aminosäureaustausch oder die reine Chemosynthese, stellen keine Produktionsalternativen dar. Obgleich gentechnisch produziertes Humaninsulin weniger immunogen ist als Schweine- oder Rinderinsulin, scheuen gut eingestellte Diabetiker den Wechsel von den Insulinen tierischen Ursprungs zum gentechnisch produzierten Produkt, so daß das Humaninsulin die Insuline tierischen Ursprungs nicht sofort vom Markt verdrängen konnte. Die Zufuhr des Insulins erfolgt heute meist mittels Injektion. Alle Versuche, das Hormon in Kapseln oder Emulsionen vor dem Angriff der Magensäure zu schützen, blieben bisher erfolglos. Weitere Entwicklungen zielen auf Insulinsprays und Insulinpumpen. Letztere setzten sich langsam durch, da man mit Hilfe der kontinuierlichen Insulinzufuhr dem gefürchteten und mitunter lebensbedrohlichen Abfall der Blutzuckerkonzentration besser vorbeugen kann und insgesamt weniger Insulin benötigt wird. Chain (E.B.), Gilbert (W.), insulin like growth factor, Insulinresistenz, Macleod (J.J.R.), Murphy (W.P.); Chromosomenkarte ( Chromosomenkarte I
Chromosomenkarte II
Chromosomenkarte III
Chromosomenkarte IV
), Hormone .
L.M./Ch.J./S.Kl.

Insulin
Abb. 1: Aminosäuresequenz und Positionen der Disulfidbrücken im Rinderinsulin. Beim Humaninsulin ( Hormone ) sind in der A-Kette die Positionen 8 (Ala) und 10 (Val) gegen Thr und Ile, in der B-Kette das C-terminale Ala gegen Thr ausgetauscht.
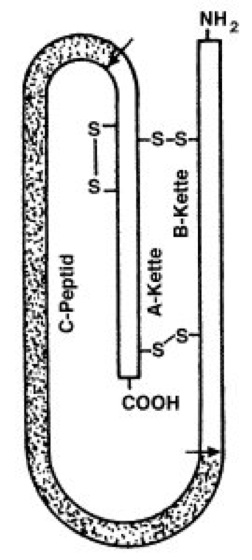
Insulin
Abb. 2: Struktur des Proinsulins, in dem die A- und B-Kette des reifen Insulins durch das C-Peptid (connection peptide) getrennt sind. Die 3 Disulfidbindungen sind bereits vorhanden. Im C-Peptid sind die Aminosäureabfolgen Arg–Arg am Aminoende und Lys–Arg am Carboxylende hoch konserviert und als Spaltungsstellen (Pfeile) für die proteolytische Entfernung des C-Peptids von Bedeutung.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.