Lexikon der Biologie: patch-clamp-Methode
patch-clamp-Methode w, patch-clamp-Technik, eine moderne Variante der Spannungsklemmtechnik (voltage-clamp-Methode), mit der Ionenströme (Ionen, Membrantransport) durch einzelne Kanäle in einer Plasma-Membran (Ionenkanäle) gemessen werden können ( vgl. Abb. 1a und vgl. Abb. 1b ). Wenn Ionenströme über Membrankanäle von Zellen fließen, führt dies zu einer Verschiebung des Membranpotentials in die de- oder hyperpolarisierende Richtung (Depolarisation, Hyperpolarisation). Durch Injektion von positivem oder negativem Strom (Klemmstrom) in die Zelle können aber die Membranpotentialverschiebung kompensiert und das Membranpotential auf einem beliebigen Wert festgehalten (geklemmt) werden. Änderungen dieses Klemmstroms spiegeln also direkt proportional Ionenströme über die Zellmembran wider. Die patch-clamp-Technik erlaubt die Messung von Membranströmen ohne Veränderungen der elektrochemischen Gradienten der beteiligten Ionen oder den störenden Einfluß der Membrankapazität. Weiterhin kann ein bestimmter Ionenstrom von kontaminierenden weiteren Ionenströmen isoliert werden. Dies läßt sich dadurch erreichen, daß das unerwünschte Ion aus der Bad- bzw. Pipettenlösung entfernt oder der beteiligte Kanaltyp mittels einer Blockersubstanz (oder Wahl eines inaktivierenden Haltepotentials) ausgeschaltet wird. Die Spannungsklemmtechnik erfordert üblicherweise, daß die Ableitung und Strominjektion über 2 getrennte Mikroelektroden erfolgen. Dies zwingt dazu, als Versuchsobjekte relativ große Zellen zu wählen, wie man sie bei wirbellosen Tieren findet. An bedeutend kleineren Zellen von Säugetieren oder des Menschen kann mit Hilfe der switch-clamp-Technik oder patch-clamp-Technik abgeleitet werden. Im switch-(Wechsel-)Klemmverfahren wird dieselbe Mikroelektrode alternierend als Ableit- (Ableitung) und Injektionselektrode benutzt. Da der Widerstand der Elektroden typischerweise zwischen 10 und 100 MΩ variiert (Spitzendurchmesser < 0,1 μm), erreichen die Zelle nur kleine Klemmströme. Dies kann an bestimmten Membranarealen und vor allem bei schnellen Ionenströmen zur inkompletten Kontrolle des Membranpotentials führen. Patch-Pipetten ( vgl. Abb. 2 ) hingegen haben relativ niedrige Widerstände (1–10 MΩ; Spitzendurchmesser > 1 μm). Sie werden im Gegensatz zu den intrazellulären Mikroelektroden nicht in das Zellinnere eingeführt, sondern auf die Zelloberfläche aufgesetzt. Danach kann das unter der Pipette liegende Membranteilchen aufgerissen und eine elektrische Kontinuität zwischen dem Zellinnern und der Pipettenlösung hergestellt werden (sog. whole-cell-Konfiguration der patch-clamp-Technik). Der mechanische Kontakt zwischen dem Pipettenrand und der Zellmembran ist extrem dicht. Dies wird durch glatte Membran- und Randflächen (enzymatische Behandlung der Zellen, Hitzepolieren der Pipetten) sowie durch ein Ansaugen der Membran in die Pipettenöffnung gewährleistet. Dadurch entsteht ein sehr hoher elektrischer Widerstand (Gigaohm-Seal), der das Hintergrund-Rauschen minimiert und die Diffusion von Flüssigkeit aus dem Zellinnern in die Badlösung (oder umgekehrt) verhindert. Das Membranpotential von kleinen Zellen (mit einem Durchmesser von unter 20 μm) wird mit der whole-cell-Methode hervorragend kontrolliert. Ein weiterer Vorteil dieser Technik besteht darin, daß verschiedene der Pipettenlösung beigemischte Substanzen schnell in das Zellinnere diffundieren. Allerdings verlassen auch lösliche, regulatorische Komponenten den Intrazellularraum. Dies kann zur allmählichen Abnahme der Öffnungswahrscheinlichkeit gewisser second-messenger-gesteuerter Kanäle (z.B. spannungsabhängiger Ca2+-Kanal; Calciumkanäle, spannungsgesteuerte Ionenkanäle) führen. Während ein Gleichgewicht kleiner Ionen sich schon nach einigen Sekunden einstellt, liegt diese Zeit bei second messengern zwischen 10 Sekunden und 1 Minute, bei kleinen regulatorischen Proteinen aber bei wenigen Minuten. Elektrische Aktivität kann auch ohne Aufreißen der Zellmembran, bereits nach Auflegen und Ansaugen der patch-Pipette, in der cell-attached-Konfiguration (cell-attached-mode, Gigaohmversiegelung) der patch-clamp-Methode registriert werden. Wenn die Pipettenöffnung ausreichend klein ist, befindet sich darunter nur ein einziger Ionenkanal. Solche Messungen wurden ursprünglich an Endplatten-Regionen von Skelettmuskelfasern durchgeführt. Nach Applikation von Acetylcholin oder seiner Strukturanaloga in die Pipettenlösung kam es zum wiederholten Erscheinen kurzlebiger, elementarer Endplatten-Ströme mit einer Amplitude von 3–5 Pikoampere und einer Dauer von einigen Millisekunden. Diese Ströme beruhten auf der vorübergehenden Öffnung eines einzigen nicotinischen Acetylcholinrezeptor-Kanals. Dieser Kanal befindet sich entweder im ganz geöffneten oder im ganz geschlossenen Zustand. Ein Miniatur-Endplattenpotential, das die postsynaptische Wirkung eines Acetylcholin-Quantums darstellt, wird durch die gleichzeitige Öffnung von etwa 1000 Endplatten-Kanälen ausgelöst (Endplattenrauschen). Ähnliche elementare Ströme erscheinen auch nach der chemischen oder spannungsabhängigen Aktivierung weiterer Ionenkanäle. Die Leitfähigkeit dieser unterschiedlichen Kanaltypen ist sehr variabel. Spannungsabhängige Kanäle können ohmsche oder gleichrichtende Eigenschaften aufweisen. In diesem Fall lassen sie den Fluß von Ionen vorwiegend nur in einer Richtung, entweder in das Zellinnere oder das Zelläußere, zu. Der Potentialbereich, in dem Aktivität auftritt, und die Dynamik der Kanaltätigkeit sind auch Kanal-spezifisch. Es gibt Kanäle, die sehr schnell öffnen und schließen, andere zeigen einen häufigen Wechsel des Zustands, wieder andere weisen lang andauernde Zyklen auf. Auch kompliziertere Formen, wie z.B. das "bursten" (viele gruppiert auftretende kurze Öffnungen), sind möglich. Die graphische Repräsentation erfolgt üblicherweise durch Histogramme der Offen- und Geschlossen-Zeitverteilungen, die durch Anpassung einer mathematischen Funktion an die gemessenen Daten ausgewertet werden. Der Abfall der Häufigkeit kann mit einer oder auch mit mehreren Zeitkonstanten behaftet sein. Zusätzlich ist die Bestimmung des Strom-Spannung-Verhältnisses von Interesse. Die Einzelkanalaktivität kann auch am isolierten patch gemessen werden. Wenn die Pipette im cell-attached-Modus von der Zelle abgehoben wird, entsteht ein inside-out-patch (excised-patch-mode, Innenseite nach außen). Ein ähnliches Verfahren im whole-cell-Modus führt zur Entstehung eines outside-out-patch (Außenseite nach außen). Nun kann der Einfluß von verschiedenen direkt auf die Außen- oder Innenseite der Membran applizierten Substanzen auf die Einzelkanalaktivität untersucht werden. Häufig ist es wünschenswert, daß es im whole-cell-Modus zu keinem Austausch von größeren Molekülen zwischen dem Intrazellularraum und der Pipettenlösung kommt. Wenn die cell-attached-Konfiguration mit einer Nystatin-haltigen Pipettenlösung hergestellt wird, sinkt der Membranwiderstand im Bereich unter der Pipette so weit, daß Ströme über die gesamte Zellmembran gemessen werden können. Dieser Zugang wird als perforated patch bezeichnet, da Nystatin in die Zellwand eingebaut wird und dort kationische Kanäle bildet, ohne größere Membranschäden zu erzeugen. Ursprünglich wurden für patch-clamp-Ableitungen vorwiegend kultivierte Zellen verwendet. Die dafür notwendige enzymatische Behandlung kann aber zu Änderungen der elektrischen Eigenschaften führen. Neuerdings werden auch unbehandelte Zellen im Gewebeverbund für Ableitungen herangezogen. Im Hirnschnittpräparat ist es möglich, einzelne oberflächliche Zellen nach vorhergehender mechanischer Reinigung oder sogar ohne jegliche Behandlung für patch-clamp-Messungen (whole-cell-Technik oder isolierte patches) zu verwenden. Die loose-patch-Methode wird an nativen Muskelpräparaten angewandt; hier wird eine relativ große Pipette (Spitzendurchmesser 20 μm) auf die Oberfläche einer Muskelfaser gesenkt. Da es nur einen niederohmigen Kontakt mit der Zellmembran gibt, müssen spezielle Verstärker zur Kompensation des Seal-Widerstands verwendet werden. Neher (E.), Sakmann (B.), Xenopus-Oocyten-Expressionssystem.
P.I.
Lit.: Numberger, M., Draguhn, A.: Patch-Clamp-Technik. Heidelberg 1996.
patch-clamp-Methode
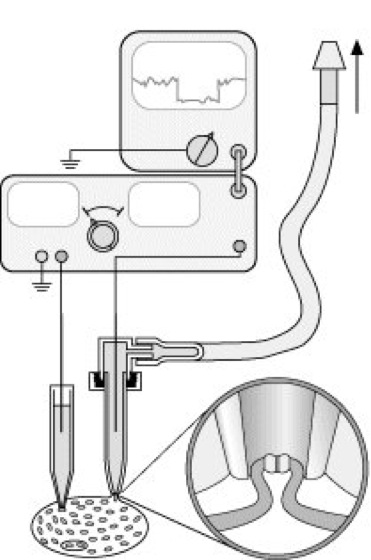
Abb. 1a: Die von den Nobelpreisträgern E. Neher und B. Sakmann entwickelte patch-clamp-Technik (patch clamp = "Membranfleckklemme") macht die Untersuchung sehr kleiner Membranstücke aus einem Zellbereich, in dem ionenselektive Kanäle vermutet werden, möglich. Die Abb. demonstriert das Prinzip einer sog. cell-attached-Konfiguration: zur Messung des Öffnens und Schließens einzelner Ionenkanäle wird ein Membranfleck mittels einer Pipette mit ausreichend kleiner Öffnung angesogen. Über eine zweite Mikroelektrode wird eine Prüfspannung angelegt und ein Strom durch die Saugelektrode geschickt.
patch-clamp-Methode
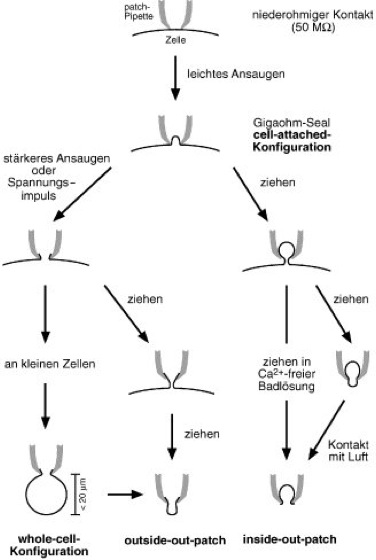
Abb. 1b zeigt verschiedene patch-clamp-Konfigurationen. Einfaches Aufsetzen der patch-Pipette auf die Zelle führt zur Ausbildung eines niederohmigen Widerstands am Pipettenrand, der nach leichtem Ansaugen in einen Gigaohm-Seal übergeht (cell-attached-Modus). Diese Ableitkonfiguration ist zur Registrierung von Einzelkanalaktivität geeignet. Durch weiteres stärkeres Ansaugen oder durch einen Spannungsimpuls kann das unter der Pipette liegende Membranareal aufgerissen werden. An kleinen (Durchmesser etwa 10 μm) Zellen können nun Ionenströme über die gesamte Membran gemessen werden (whole-cell-Ableitung). Wenn die Pipette danach von der Zelle abgehoben wird, reißt ein Membranteilchen ab und schließt sich zu einem outside-out-patch (Außenseite nach außen). Alternativ kann die Pipette bereits im cell-attached-Modus von der Zelle abgehoben werden. Dies führt zur Bildung einer isolierten Membranvesikel, die sich öffnet, wenn die Pipettenspitze kurzzeitig aus der Badlösung gehoben und mit der Luft in Kontakt gebracht wird; nun ist die Innenseite der Membran gegen die Badlösung gekehrt (inside-out-patch). In einer Ca2+-freien Badlösung kommt es zu keiner Vesikelbildung; der isolierte patch geht unmittelbar in die inside-out-Konfiguration über.
patch-clamp-Methode
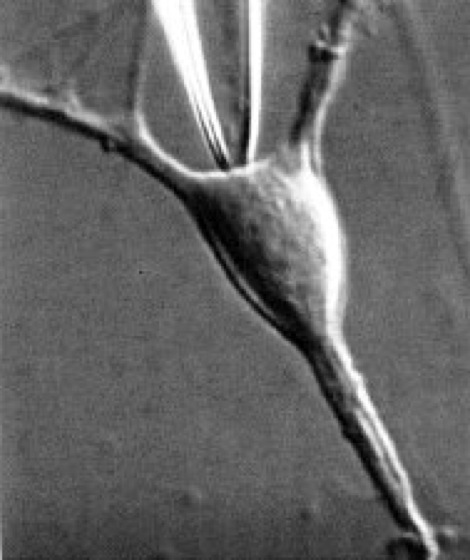
Abb. 2: auf eine kanalhaltige Membran aufgesetzte Glaspipette mit einem Spitzendurchmesser von ca. 1 μm
Schreiben Sie uns!