Lexikon der Biologie: Photosynthese

Photosynthese w [von *photo- , griech. synthesis = Zusammensetzung], die Synthese energiereicher organischer Verbindungen aus energiearmen anorganischen Molekülen mit Hilfe der in elektrochemisches Potential transformierten Strahlungs-Energie des Sonnenlichts (Licht, Lichtfaktor; Energieflußdiagramm [Abb.]). Ausgangssubstanzen der Photosynthese sind bei den grünen Pflanzen (s.u.) CO2 (Kohlenstoffdioxid; Kohlendioxid) und H2O (Wasser), aus denen unter Abgabe von O2 (Sauerstoff) Glucose bzw. polymere Glucose (= Stärke) aufgebaut wird.
Die entsprechende Summenformel der Photosynthese lautet: 12 H2O +6 CO2 → C6H12O6 +6 O2↑ +6 H2O; ΔG°' = –2880 kJ/Mol Glucose. Die Stöchiometrie dieser Summenformel ( vgl. Infobox 1 ) bestätigen Messungen des Gaswechsels photosynthetisch aktiver Pflanzen, der in der Regel einen assimilatorischen Quotienten (Assimilationsquotient; = Mol O2 abgegeben/Mol CO2 aufgenommen) von 1 aufweist.
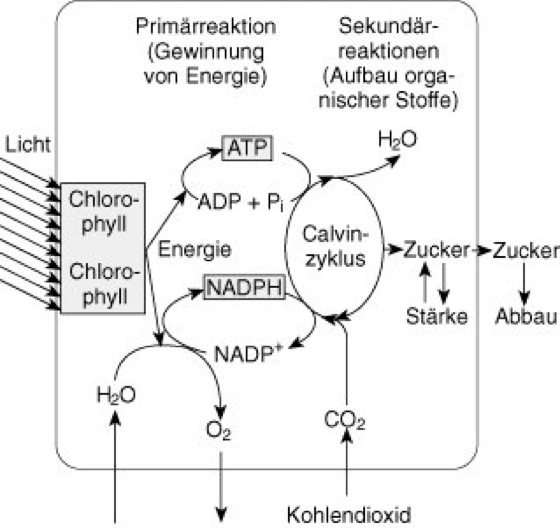
Die Photosynthese kann in die beiden Teilprozesse Lichtreaktion und Dunkelreaktion untergliedert werden. Im Rahmen der Lichtreaktion wird H2O unter Elektronenabgabe (Elektron) zu 1/2O2 und 2H+ gespalten (Photolyse des Wassers). Während O2 nach außen abgegeben wird, werden die Elektronen durch Licht-Absorption in 2 sog. Photosystemen (s.u.) über Elektronentransportketten NADP+ (Nicotinamidadenindinucleotidphosphat) zugeführt, das hierdurch zu NADPH2 reduziert wird. Bei diesem Elektronentransport wird gleichzeitig Energie frei und durch Bildung von ATP (Adenosintriphosphat; Photophosphorylierung) chemisch gebunden (chemische Energie).
In der Dunkelreaktion wird diese Energie dazu eingesetzt, um aus energiearmen anorganischen Molekülen (z.B. CO2; Kohlendioxidassimilation) energiereiche organische Verbindungen zu synthetisieren, wobei gleichzeitig die Reduktionsäquivalente (Redoxreaktionen) des NADPH2 einfließen ( vgl. Abb. 1 ).
Organismen, die über die Photosynthese Lichtenergie in chemisch gebundene Energie umwandeln können, sind alle grünen Pflanzen (Samenpflanzen und Farnpflanzen, Moose und Algen), die Cyanobakterien und einige Bakteriengruppen (phototrophe Bakterien). Letztere betreiben allerdings eine sog. anoxygene Photosynthese, da sie andere Substanzen als H2O als Elektronendonoren verwenden und daher nicht O2 freisetzen. – Die Photosynthese findet bei den grünen Pflanzen in speziellen Organellen, den Chloroplasten (Farbtafel), statt ( vgl. Infobox 2 ), wobei die verschiedenen Prozesse der Lichtreaktion in bzw. an den Thylakoidmembranen, die der Dunkelreaktion dagegen im Stroma ablaufen.
Lichtreaktion:
Die Absorption der Licht-Quanten erfolgt durch verschiedene Photosynthesepigmente (Antennenpigmente), die – an Proteine gebunden – in den Thylakoidmembranen um ein sog. Reaktionszentrum (s.u.) gruppiert sind und als Lichtsammelkomplex (Light Harvesting Complex, LHC) bezeichnet werden ( vgl. Infobox 3 ). Alle Photosynthesepigmente verfügen über jeweils charakteristische Absorptionsspektren. Hauptpigment der Photosynthese ist, außer bei den Bakterien, die sog. Bakteriochlorophylle besitzen, das Chlorophyll a (Chlorophylle [Abb.]). Daneben sind Carotinoide, Chlorophyll b oder c und bei Rotalgen und Cyanobakterien Phycobiline (Phycobiliproteine) vertreten.
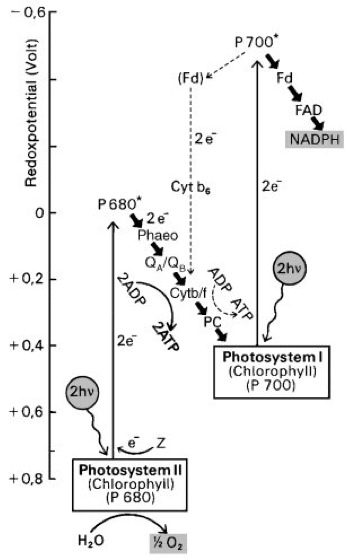
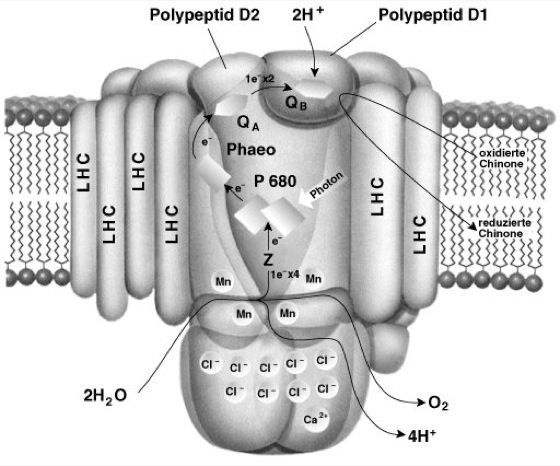
Die Absorption eines Lichtquants durch das π-Elektronensystem eines Antennenpigments im LHC bewirkt den Übergang vom Grundzustand in einen angeregten Zustand (Anregung). Dabei sind die Pigmente im LHC so arrangiert, daß dieser Anregungszustand durch Fluoreszenz auf ein benachbartes zweites Pigment übergehen kann. Die Absorptions- und Emissionseigenschaften sind so abgestimmt, daß das Absorptionsspektrum des aufnehmenden Pigments mit dem Fluoreszenzspektrum des übertragenden Pigments überlappt. Dieser Prozeß erfolgt mehrere Male mit zunehmenden Wellenlängen, bis die Anregungsenergie beim Reaktionszentrum (Lichtfalle) mit dem längstwelligen Absorptionsmaximum (680 nm; P680) ankommt. Dort führt die Anregung des π-Elektronensystems zu einer drastischen Veränderung der Reduktionskraft (Redoxpotential) des Chlorophyllmoleküls. Das Reaktionszentrum liegt innerhalb der Thylakoidmembran, welche, wie jede Elementar-Membran, nur eingeschränkt durchlässig ist und wie ein Kondensator wirkt, der dann elektrisch aufgeladen wird, wenn elektrische Ladungen über die Membran transportiert werden. Die Elektronenabgabe erfolgt vom angeregten Reaktionszentrum an ein stromaseitig angelagertes Phäophytin, welches das Elektron wieder stromaseitig an ein Chinon A und dieses an ein Chinon B weiterleitet (Chinone). Chinon B kann frei diffundieren (Diffusion), wenn es 2 Elektronen erhalten hat. Diese 2 Elektronen werden dann (natürlich mit Protonen neutralisiert als QB-H2) über einige weitere Elektronen-Carrier (Cytb-f, PC; Cytochrome) zum zweiten, benachbarten Reaktionszentrum (P700) geleitet ( vgl. Abb. 2 ). (Dieses Photosystem wurde zuerst entdeckt und wird deswegen PS I genannt, während P680 als PS II bezeichnet wird. Wegen der immensen Komplexität von Photosystem II ( vgl. Abb. 3 ) kamen viele Erkenntnisse aus Studien an äquivalenten Systemen in photosynthetischen Bakterien. Die Arbeiten von J. Deisenhofer, R. Huber und H. Michel, die die Struktur des photosynthetischen Reaktionszentrums ( Proteine II ) im Bakterium Rhodopseudomonas viridis ermittelten, brachten ihnen 1988 den Nobelpreis in Chemie.)
P700 ist nach erfolgter Elektronenaufnahme von PC und Energieübertragung von den Antennenpigmenten im angeregten Zustand so stark reduzierend (Reduktion), daß in der folgenden Reduktionskette die Elektronen auf NADP+ übertragen werden können. Zurückgeblieben ist bei diesem Prozeß ein oxidiertes P680+. Dieses Elektronenloch wird von der anderen (Innen-)Seite her durch einen Elektronendonor „Z“ aufgefüllt. Dieser Donor erhält sein Elektron wiederum von einem mit 4 Manganatomen (Mangan) ausgestatteten Komplex, der in einem zyklischen, 4stufigen Prozeß pro Durchlauf aus 2 H2O-Molekülen unter O2-Abspaltung 4 Elektronen an „Z“ abliefert und 4 Protonen in das Medium entläßt.
Die Produktion von Reduktionsäquivalenten erfolgt somit am P700, die Sauerstoffproduktion am P680 und die Produktion von ATP an einer benachbarten ATPase (Adenosintriphosphatasen), die den durch die entgegengesetzte Wanderung von negativer und positiver Ladung im P680 an der Membran entstandenen Protonengradienten (protonenmotorische Kraft) als Energiequelle benutzt (Photophosphorylierung). Um 1 Elektron zu transportieren, müssen also 2 Lichtquanten (eines von Photosystem II und eines von Photosystem I) absorbiert werden. Daraus ergibt sich nach der formalen Gleichung 2 H2O → O2 +4 H+ +4 e– ein Quantenbedarf (Anzahl von Lichtquanten, die zur Bildung eines Moleküls O2 nötig ist) von 8.
Neben diesem irreversiblen Elektronentransport auf NADP+ existiert die Möglichkeit eines zyklischen Elektronentransports, wenn Ferredoxin nicht NADP+ reduziert, sondern sein Elektron zurück in die intermediäre Redoxkette geleitet wird. Dieser zyklische Transport erfolgt, wenn bei CO2-Mangel ein NADPH2-Stau auftritt, und ermöglicht ebenfalls die Bildung von ATP (zyklische Photophosphorylierung).
Dunkelreaktion:
Die energiereichen Produkte der Lichtreaktion, ATP und NADPH2, stehen für endergonische Reaktionen im Stroma der Chloroplasten zur Verfügung, die somit nur mittelbar lichtabhängig sind und deshalb als Dunkelreaktion der Photosynthese bezeichnet werden. CO2 wird hierbei an Ribulose-1,5-bisphosphat (Ribulose-1,5-diphosphat) fixiert, das in 2 Moleküle 3-Phosphoglycerat zerfällt. Diese werden zu Glycerinaldehyd-3-phosphat (Triosephosphat) reduziert. Ein Teil der Triosephosphate wird zur Wiederherstellung von Ribulose-1,5-bisphosphat verwendet (Calvin-Zyklus), der überwiegende Rest dient zum Aufbau des gesamten organischen Materials (nicht nur der Pflanze, auch der Erde). Je nach Entwicklungsstadium der Chloroplasten werden verschiedene Photosyntheseprodukte synthetisiert. Polysaccharide und Aminosäuren können im Chloroplasten selbst synthetisiert werden. Dabei ist Fructose-6-phosphat das Ausgangsmolekül für die Stärke-Synthese, Phosphoenolpyruvat für die der Aminosäuren (die dazu erforderliche Stickstoffassimilation ist ebenfalls Photosyntheseenergie-abhängig). Triosephosphate (nicht Hexosen, wie früher angenommen) sind die Transportmetabolite des Calvin-Zyklus ins Cytoplasma, wo Glucose und Saccharose synthetisiert werden. Ribulose-1,5-bisphosphat-Carboxylase (Rubisco; Ribulose-1,5-diphosphat-Carboxylase), das Schlüsselenzym der Kohlenstoffixierung, zeigt auch Oxygenase-Aktivität, so daß sich in Anwesenheit von O2 aus Ribulose-1,5-bisphosphat neben 3-Phosphoglycerat auch Glykolat (Glykolsäure) bilden kann, das in den Zyklus der Photorespiration eingeht.
Die Photorespiration bringt eine Einbuße der Energieausbeute der Photosynthese mit sich: Bruttophotosynthese – Photorespiration = Nettophotosynthese. Ihre physiologische Rolle ist ungeklärt. Möglicherweise mußte sie mit steigender O2-Konzentration der Atmosphäre „in Kauf genommen werden“.
Bedeutung der Photosynthese:
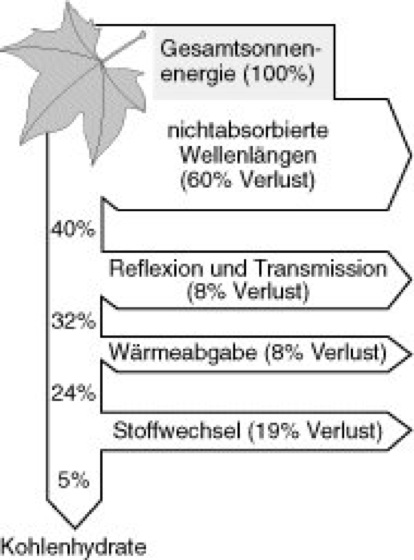
Die Photosynthese ist der grundlegende bioenergetisch-synthetische Prozeß (Bioenergie, Biomasse), von dem – mit Ausnahme der chemoautotrophen Bakterien (Chemolithotrophie) – alles Leben auf der Erde abhängt. Nur durch die Photosynthese kann die Strahlungsenergie des Sonnenlichts ( vgl. Abb. 4 ) in chemisch gebundene Energie umgewandelt werden. Die Photosynthese liefert die energiereichen Substrate sowohl für den Stoffwechsel der photoautotrophen Organismen selbst (Autotrophie) als auch aller heterotrophen Lebewesen (Heterotrophie; Ernährung [Tab.]) und stellt gleichzeitig O2 für die Dissimilation (Farbtafel) dieser Substrate bereit.
Im Lauf der Evolution hat der Photosyntheseapparat folgende Entwicklung erfahren: Als ursprünglicheres System wird das Photosystem I angenommen, mit dessen Hilfe für autotrophes Leben Elektronendonoren mit relativ niedrigem Redoxpotential genutzt werden können. Purpurbakterien waren vermutlich die ersten photosynthetisch aktiven Organismen. Mit der Evolution des Photosystems II wurde später das universell vorhandene H2O als Elektronendonor nutzbar und damit die Produktion von molekularem O2 möglich, was wiederum die Grundlage zur Entwicklung aerober Organismen (Aerobier) bildete.
Der Photosyntheseapparat der heutigen Pflanzen ist ihren äußeren und inneren Bedingungen angepaßt und mehrfach vor allem bezüglich Lichtausnutzung und CO2-Fixierung optimiert worden. Beispielsweise liegt bei Starklichtpflanzen (oder auch in den Lichtblättern einer Pflanze; Heliophyten) die Photosyntheseintensität bei Lichtsättigung höher als bei Schwachlichtpflanzen (oder Schattenblättern; Schattenpflanzen), während letztere z.B. durch morphologische Anpassung (Photomorphose) ihren Lichtkompensationspunkt und maximale Photosyntheseleistung schon bei niedrigerer Lichtintensität als die Starklichtpflanzen erreichen.
Für Pflanzen, die an Standorten mit hohem Lichtangebot wachsen, wird die CO2-Konzentration der Luft zum limitierenden Faktor der Photosynthese ( vgl. Abb. 5 ). Hier ermöglichen besondere Mechanismen der CO2-Fixierung eine Steigerung der Photosyntheseintensität: Im Assimilationsgewebe von sog. C4-Pflanzen liegen um die Leitbündel Scheidenzellen, die wiederum von Mesophyllzellen (Blatt) umgeben sind. In den Chloroplasten der Mesophyllzellen wird CO2 nicht in Triosephosphat-Moleküle eingebaut (C3-Körper), sondern zunächst im Cytoplasma über eine Addition an Phosphoenolpyruvat (PEP) im Oxalacetat fixiert (C4-Körper). Das beteiligte Enzym PEP-Carboxylase (Phosphoenolpyruvat-Carboxylase) besitzt im Gegensatz zur Rubisco keine Oxygenase-Aktivität. Zum Transport in die Bündelscheidenzellen wird Oxalacetat in den Chloroplasten der Mesophyllzellen zu z.B. Malat reduziert. Nach dem Import in die Chloroplasten der Bündelscheidenzellen wird Malat zu Pyruvat decarboxyliert (Decarboxylierung). Dadurch erhöht sich die Konzentration an CO2 so stark, daß die Fixierung des Kohlenstoffs durch Rubisco nicht mehr durch O2 gestört werden kann (Hatch-Slack-Zyklus = C4-Dicarboxylat-Zyklus). Wie effizient dieser Mechanismus ist, zeigen die besonders niedrige CO2-Kompensationskonzentration (= CO2-Konzentration des Gleichgewichts zwischen Photosynthese und Atmung; Kompensationspunkt) von C4-Pflanzen gegenüber C3-Pflanzen sowie die besonders hohe photosynthetische Stoffproduktion, die z.B. Mais oder Zuckerrohr erreichen. Auch Pflanzen arider Standorte profitieren vom C4-Dicarboxylatzyklus, denn die effektivere CO2-Fixierung erlaubt ein schnelleres Schließen der Stomata (Spaltöffnungen) und somit geringeren Wasserverlust, als dies C3-Pflanzen möglich ist.
Nicht eine räumliche, sondern eine zeitliche Trennung von CO2-Fixierung und -Reduzierung nutzen die sog. CAM-Pflanzen (CAM = Crassulacean acid metabolism) – ebenfalls Pflanzen arider Standorte (viele Sukkulenten), die nachts, wenn bei Stomata-Öffnung kein Wasserverlust droht, CO2 an Säuren fixieren, das dann tags bei geschlossenen Stomata in den Calvin-Zyklus eingeschleust wird (diurnaler Säurerhythmus). Pflanzen scheinen sich auch dem durch die Industrialisierung bedingten Anstieg der CO2-Konzentration (Kohlendioxid [Abb.]) in der Atmosphäre anzupassen: mit zunehmender CO2-Konzentration bilden Pflanzen weniger Stomata, um Wasser einsparen zu können. Biochemie (Geschichte der), Biophysik, Blattflächenindex, Calvin (M.), Chronobiologie, Cyanobakterien (Abb.), D1-Protein, Enzyme, Erdgeschichte, Evolution der Eucyte, Gluconeogenese, Hill-Reaktion, Ingenhousz (J.), Kamen (M.D.), Kohlenhydratstoffwechsel, Kohlenstoffkreislauf (Farbtafel), Lichtschutzmechanismen, Lichtstreß, OEC, Pflanzenphysiologie, Pflanzenstreß, Photoinhibition, Photooxidation, Priestley (J.), Quantosom, Q-Zyklus, Sachs (J.), Warburg (O.H.); Photosynthese I Photosynthese II , Dissimilation II .
D.W./B.La.
Lit.: Govindjee, R. (ed.): Photosynthesis. Vol. 1, Energy conversion by plants and bacteria. Vol. 2, Development, carbon metabolism and plant productivity. New York 1982. Lawlor, D.W.: Photosynthese. Stoffwechsel, Kontrolle, Physiologie. Stuttgart 1990.
Photosynthese
Abb. 1: Vereinfachte Darstellung der an der Photosynthese beteiligten Reaktionen
Photosynthese
Abb. 2: Elektronentransport und Photophosphorylierung in der aeroben Photosynthese. Die gestrichelten Linien zeigen den möglichen zyklischen Elektronentransport, bei dem nur ATP gebildet wird.
ADP = Adenosin-5'-diphosphat, ATP = Adenosintriphosphat, Cyt b/f = Cytochrome b und f, e– = Elektron, FAD = Flavinadenindinucleotid, Fd = Ferredoxin, hν = Lichtquant, NADPH = reduzierte Form von Nicotinamidadenindinucleotidphosphat, P680*, P700* = angeregte Chlorophyllmoleküle, PC = Plastocyanin, Phaeo = Phäophytin, QA, QB = Plastochinone, Z = primärer Elektronendonor.
Photosynthese
Abb. 3: Vereinfachtes Modell des Photosystems II zur Veranschaulichung des Primärprozesses der Photosynthese.
Gestartet wird die Reaktion durch die Absorption eines Photons vom Reaktionszentrum P680, das im angeregten Zustand stark reduzierend wirkt. Die daraufhin anlaufende Reduktionskette transportiert das von P680 abgegebene Elektron zu frei beweglichen Chinonen, welche die Ladung an P700 weiterleiten. Auf der anderen (Innen-)Seite der Membran werden die Elektronen durch den Wasserspaltungskomplex an das Reaktionszentrum nachgeliefert. Die bei der Oxidation des Wassers entstehenden Protonen verursachen die elektrostatische Aufladung der Membran. Diese Energie wird zur ATP-Synthese verwendet. Das gesamte System ist auf 2 Polypeptiden (relative Molekülmasse jeweils 32.000) lokalisiert und von Molekülen des Lichtsammelkomplexes (LHC) umhüllt.
LHC = Light Harvesting Complex, Z = primärer Elektronendonor, Phaeo = Phäophytin, QA und QB = (Plasto-)Chinone.
Photosynthese
Abb. 4: Während der Photosynthese wird nur ein geringer Anteil von etwa 5% der auf die Blattoberfläche auftreffenden Sonnenenergie letztlich chemisch in Form von Kohlenhydraten fixiert. Dies liegt daran, daß der größte Teil des Lichts zu kurz- bzw. langwellig ist, um von den Photosynthesepigmenten absorbiert zu werden. Nur die sog. photosynthetisch aktive Strahlung (Abk. PAR) im Bereich von 400–700 nm kann für die Photosynthese genutzt werden. Weitere Verluste sind Reflexion und Transmission sowie Wärmeabgabe, bei der Anteile der ursprünglich absorbierten Lichtenergie verloren gehen. Anpassungen an unterschiedliche Lichtverhältnisse spiegeln sich in der Blattanatomie wie z.B. bei Licht- und Schattenblättern wider, die neben Chloroplastenbewegungen und Blattbewegungen (Phototropismus) die Lichtabsorption am Wuchsort maximieren sollen (Lichtkompensationspunkt). Bei schwachem Licht, d.h. geringem Lichtfluß (Fluenzrate), ist die Photosynthese in der Regel durch Licht limitiert, so daß eine höhere Lichtmenge zu einer stärken Photosynthese führt, bis ein bestimmter Lichtsättigungswert erreicht ist. Die Photosynthese wird bei noch höheren Lichtflüssen als CO2-limitiert bezeichnet, weil die Enzyme des Calvin-Zyklus nicht in der Lage sind, mit der absorbierten Lichtenergie mithalten zu können. Sehr starkes Licht kann zudem in Photoinhibition resultieren – was dadurch bedingt ist, daß die aufgenommene Lichtenergie nicht mehr abgeleitet werden kann, so daß das Chlorophyll in den langlebigen Triplettzustand angehoben wird und sich freie Radikale bilden, die das Pigment oder die benachbarten Proteine oxidieren.
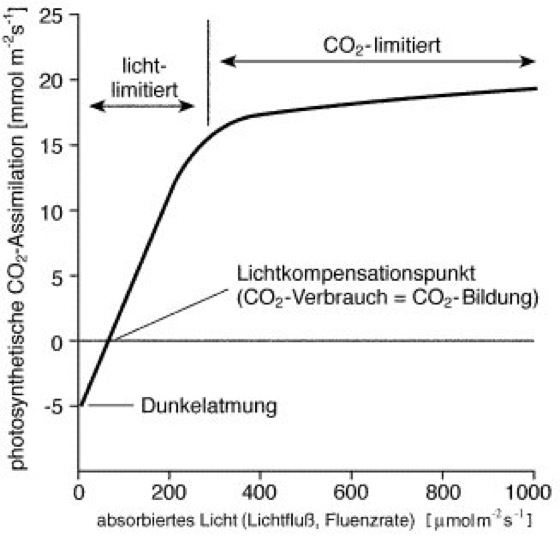
Photosynthese
Abb. 5: Abhängigkeit der Photosynthese vom Lichtfluß (Fluenzrate) PAR (photosynthetic available radiation, Wellenlängen zwischen 450 und 700 nm) am Beispiel einer C3-Pflanze. Während der Dunkelatmung kommt es zu einer Nettoproduktion von CO2, erst beim Erreichen einer bestimmten Beleuchtungsstärke wird CO2 in Form von Kohlenhydraten fixiert (Lichtkompensationspunkt). In Abhängigkeit von der einfallenden Lichtmenge ist die photosynthetische CO2-Assimilation lichtlimitiert bzw. CO2-limitiert.
Schreiben Sie uns!