Lexikon der Biologie: Signaltransduktion
Signaltransduktion w, Umwandlung eines extrazellulären Signals in eine intrazelluläre „Antwort“ ( vgl. Infobox ). Eine Zelle kann auf sehr verschiedenartige äußere Reize, z.B. Hormone, Wachstumsfaktoren und Neurotransmitter – also sog. primäre Boten –, ebenso reagieren wie auf unterschiedlichste physikalische Reize, z.B. Licht (Photorezeption) oder Temperatur (Hitzeschock; heat-shock-response) oder auf biotische Reize, wie z.B. Pathogene oder Pheromone. Die Kompetenz, bestimmte Reize aufzunehmen, ist jedoch nicht bei allen Zelltypen gleichermaßen ausgeprägt. Während einzellige Organismen (Einzeller) direkt auf Umweltreize reagieren müssen (z.B. Chemotaxis), ist die Signaltransduktion vor allem für die Kommunikation verschiedener Zellen (Zellkommunikation) oder Zelltypen innerhalb eines vielzelligen Organismus von fundamentaler Bedeutung und spielt somit auch bei der Koordination von Wachstums- (Wachstum) und Entwicklungsvorgängen (Entwicklung, Embryonalentwicklung) eine entscheidende Rolle. Genetische Störungen, die Komponenten dieser Signalwege betreffen, können zu unkontrolliertem Wachstum und krebsartigen Erkrankungen (Krebs) führen (Aktivierung von Onkogenen, z.B. erbB, ras [Ras-Proteine]). Für eine Reihe unterschiedlicher Zelltypen wurde eine starke Übereinstimmung des Prozesses der intrazellulären Signaltransduktion nachgewiesen, so daß man von hoch-konservierten zellulären Mechanismen sprechen kann. Sowohl für in die Membran eingelagerte Hormonrezeptoren, die bei Bindung eines Liganden (Signalerzeugung) ihre Konformation ändern, als auch für den sensorischen Bereich finden sich hohe, zum Teil bis in molekulare Einzelheiten reichende Ähnlichkeiten (Sequenzhomologie). – Eine Möglichkeit der Aufnahme eines Reizes erfolgt über spezifische Rezeptoren an der Plasma-Membran ( vgl. Tab. ). Eine weit verbreitete Klasse von Rezeptoren sind die G-Protein gekoppelten Rezeptoren. Die Bindung eines Liganden an einen solchen Rezeptor führt zu einer strukturellen Änderung des Rezeptors, die dann eine Wechselwirkung mit stimulatorischen oder inhibitorischen Transducern erlaubt. Dieser aktive Komplex aus Ligand, Rezeptor und α-Untereinheit des G-Proteins ist in der Lage, das Signal mit Hilfe nachgeschalteter Proteine (Effektoren), z.B. der Adenylat-Cyclase oder der Phosphoinositidase, ins Zellinnere zu übertragen. Dies geschieht in diesen Fällen über sekundäre Boten, wie Calcium, cAMP oder Inositolphosphate (IP3) und Diacylglycerol (DAG; Phosphatidylinositol-Metabolismus). Einen anderen Mechanismus verwenden Rezeptoren für Hormone oder Wachstumsfaktoren, die eine intrinsische Protein-Tyrosin-Kinase-Aktivität besitzen (Rezeptor-Tyrosin-Kinasen). Diese Rezeptorkinase-Aktivität wird durch Bindung eines spezifischen Hormons, z.B. Insulin (Insulinrezeptor), oder eines spezifischen Wachstumsfaktors, z.B. epidermal growth factor (EGF), an den entsprechenden Rezeptortyp stimuliert, was dann zu einer Phosphorylierung nachgeschalteter Proteine führt. Andere Rezeptoren, z.B. die Antigenrezeptoren von B-Lymphocyten (B-Zell-Rezeptor) oder T-Lymphocyten (T-Zell-Rezeptor), verfügen nicht über eine eigene Aktivität als Tyrosin-Kinase. Eine Kreuzvernetzung mehrerer dieser Rezeptoren führt jedoch zu einer Aktivierung verschiedener intrazellulärer Tyrosin-Kinasen, die das Signal über verschiedene Wege verstärken und weiterleiten. – Generell nehmen Proteinkinasen eine zentrale Stellung in der weiteren Signalleitung ein. Einerseits führen sie über Phosphorylierungskaskaden (viele Kinasen müssen zu ihrer Aktivierung selbst phosphoryliert werden) zu einer Verstärkung und Verteilung des Signals, andererseits beeinflussen sie die Bildung der sekundären Boten und werden zum Teil selbst durch diese reguliert. So gibt es z.B. Ca2+- oder Ca2+/Calmodulin-abhängige Proteinkinasen (Calmodulin), die cAMP-regulierte Proteinkinase A (cAMP-abhängige Proteinkinase; vgl. Abb. ) und Ca2+/Diacylglycerol-gesteuerte Proteinkinasen C (Proteinkinase C). Diese Proteinkinasen, in der Regel Serin-Threonin-Kinasen, sind in der Lage, durch Phosphorylierung bestimmter Proteine (z.B. Enzyme) eine schnelle zelluläre Antwort auf einen spezifischen Reiz hervorzurufen, da die Phosphorylierung eine Änderung der biologischen Aktivität der Proteine nach sich zieht. Einen anderen Mechanismus der Signaltransduktion verwenden Steroidhormone, die wegen ihrer Lipophilität (lipophil) die Plasmamembran selbst durchqueren können. Innerhalb der Zellen binden diese Hormone an Steroidhormon-Rezeptoren (Steroidrezeptoren), die daraufhin direkt als aktivierte Transkriptionsfaktoren wirken. Die Effektoren, die das so verzweigte und regulierte Signal schließlich erreicht, können auf allen funktionellen Ebenen der Zelle wirken. Stoffwechsel-Enzyme werden in ihrer Aktivität reguliert, Cytoskelett-Proteine (Zellskelett) führen zu einem dynamischen Umbau der Zellmorphologie, die Ausschüttung weiterer Signalmoleküle wird ausgelöst. In sehr vielen Fällen bilden Transkriptionsfaktoren den Endpunkt von Signalketten, wobei die veränderte Konzentration oder Bindungsfähigkeit der Transkriptionsfaktoren zu einer geänderten Expression spezifischer Gene (Genregulation, Genexpression, differentielle Genexpression) führen. – Neben den beschriebenen Mechanismen gibt es noch verschiedene andere Wege der Signaltransduktion, wie z.B. die Öffnung oder Schließung von Ionenkanälen bei der Erregungsleitung (Nervenzelle, Synapse). In beiden bisher bekannten sensorischen Transduktionen, dem visuellen System, in dem absorbiertes Licht (Sehfarbstoffe, Photorezeption, Rhodopsin) die Ruheform des visuellen Chromophors (chromophore Gruppen) in eine aktive Form überführt und damit eine Konformationsänderung des Photorezeptorproteins induziert, als auch bei der olfaktorischen Transduktion (Geruchssinn, Geruchsrezeptoren; chemische Sinne) lassen sich inzwischen die meisten Schritte dieser Signalübermittlung, die mit einer enormen Verstärkung verbunden ist, beschreiben. Für die Wirbeltier-Stäbchenzelle ist es gelungen, alle an der Reizweiterleitung beteiligten Komponenten und die auftretenden Protein-Protein-Interaktionen zu charakterisieren. Die visuelle Transduktion stellt damit ein Modellsystem für eine Reihe ähnlicher Mechanismen der intrazellulären Reizübermittlung dar. – Signaltransduktion bei Pflanzen: Einige der bei Tieren nachgewiesenen Signaltransduktionsmechanismen sind auch bei Pflanzen nachgewiesen: so gibt es Proteinkinase-Kaskaden, G-Proteine und auch den Inositolphosphatweg. In den letzten Jahren zeigte sich jedoch, daß die Gewichtung einer Reihe von Signaltransduktionswegen bei Pflanzen unterschiedlich ist. Als weiteres Signaltransduktionssystem sind die ursprünglich bei Bakterien entdeckten Zweikomponentensysteme als weit verbreitetes Prinzip auch in Pflanzen nachgewiesen worden (z.B. beim Cytokinin-Signalweg [Cytokinine]). Im Unterschied zum Wirbeltier-Auge beruht die Verarbeitung des Lichtsignals bei Pflanzen nicht so sehr auf Absonderung von sekundären Botenstoffen ins Zellinnere. Vielmehr wandert der Photorezeptor selbst (das Phytochrom; Phytochrom-System) nach Aktivierung in den Zellkern ein und verändert dort die Aktivität bestimmter Transkriptionsfaktoren. Der Rezeptor fungiert hier also gleichzeitig als Transducer. Ein drittes wichtiges Prinzip ist die Bedeutung spezifischer Proteolyse für die Signaltransduktion. Dabei werden Repressoren der Transkription nach Anschalten des Signalwegs im Proteasom abgebaut und so die Aktivierung entsprechender Gene (Genaktivierung) durch Derepression (s.u.) ermöglicht. Es gibt daher eine Vielzahl sog. F-Box-Proteine, die an der Spezifität dieses Abbaus beteiligt sind (bei der Schmalwand etwa 700–800 im Gegensatz zu einer sehr geringen Zahl im Vertebraten-System). Es stellt sich zunehmend heraus, daß auf dieser Ebene ein komplexe Verschaltung verschiedener Signalwege stattfindet (nachgewiesen z.B. für Licht-, Auxin- [Auxine] und Jasmonatweg [Jasmonate]). Ein viertes Prinzip der pflanzlichen Signaltransduktion ist die Derepression – es zeigt sich immer mehr, daß die meisten pflanzlichen Signalwege (z.B. Ethylenweg [Ethylen], Photomorphogenese; pflanzliche Abwehr) im Grundzustand angeschaltet sind und in Abwesenheit des jeweiligen Signals aktiv unterdrückt werden müssen. Durch das Signal wird diese Unterdrückung beseitigt. Es gibt daher Mutanten, bei denen diese Unterdrückung nicht mehr funktioniert, so daß in Abwesenheit des jeweiligen Signals der entsprechende Signalweg angeschaltet wird. Actin, Acylierung von Proteinen, Adaptation, Apoptose, Biochemie (Geschichte der), Biophysik, cAMP-Kaskade, Corezeptoren, Cytokine, extrazelluläre Matrix, Geschmackstransduktion, Gibberelline, Gilman (A.G.), Glykogen (Abb.), Immunsuppression, Interleukine, Kaskadenmechanismus, Membranproteine, Mitogene, Neuromodulatoren, Neuropeptide, regulierte Exocytose, Rodbell (M.).
K.G./W.G./O.L./P.N.
Signaltransduktion
Einige Beispiele
| ||||
| Adrenalin (Hormon) | adrenerger Rezeptor | Adenylat-Cyclase (cAMP) | Herz (Erhöhung der Herzfrequenz), Muskel (Glykogenabbau), Fettzellen (Fettabbau) | |
| adrenocorticotropes Hormon (ACTH) | ACTH-Rezeptor | Adenylat-Cyclase (cAMP) | Nebennierenrinde (Cortisolsekretion) | |
| Vasopressin (Adiuretin, Hormon) | Vasopressin-Rezeptor (V1) | Phospholipase C (IP3, DAG, Ca2+) | glatte Muskulatur (erhöhter Blutdruck) | |
| Vasopressin-Rezeptor (V2) | Adenylat-Cycylase (cAMP) | Niere (vermehrte Wasserresorption) | ||
| Acetylcholin (Neurotransmitter) | Acetylcholinrezeptor | β/γ-Komplex eines G-Proteins | Herzmuskel (Erniedrigung der Herzfrequenz, Gegenspieler des Adrenalins) | |
| Thrombin (Hormon) | Thrombinrezeptor | Phospholipase C (IP3, DAG, Ca2+) | Blutplättchen (Aggregation) | |
| epidermal growth factor (EGF, Wachstumsfaktor) | EGF-Rezeptor | Ras | Epithelien und andere Gewebe (stimuliert Proliferation) | |
| nerve growth factor (NGF, Wachstumsfaktor) | NGF-Rezeptor | Ras | Nervenzellen (ermöglicht Überleben der Zellen, stimuliert Auswachsen von Axonen) | |
| Photonen | Rhodopsin | G-Protein (Transducin), cGMP | Photorezeptorzellen (Membranpotentialänderung) |
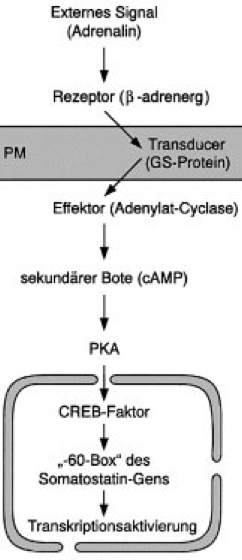
Signaltransduktion
Eines der am besten untersuchten Beispiele der Signaltransduktion ist die Aktivierung der cAMP-abhängigen Proteinkinase A (PKA; cAMP-abhängige Proteinkinase) durch Adrenalin. Dabei bindet extrazelluläres Adrenalin z.B. an β-adrenerge Rezeptoren, die über Wechselwirkung mit einem stimulierenden G-Protein (GS) an der Plasmamembran (PM) die Adenylat-Cyclase stimulieren. Dies führt zur Synthese des sekundären Boten cAMP und zur Aktivierung der PKA. Die PKA kann durch Phosphorylierung u.a. den CREB-Transkriptionsfaktor (CREB) aktivieren, der dann durch Bindung an die sog. „-60-Box“ upstream des Somatostatin-Gens (Somatostatin) die Transkription dieses Gens stimulieren kann. Andere Hormone binden an sog. inhibitorische Rezeptoren, die dann über ein inhibitorisches G-Protein die Adenylat-Cyclase hemmen.
Schreiben Sie uns!