Lexikon der Chemie: Ammoniak
Ammoniak, NH3, farbloses Gas von charakteristischem, stechendem, zu Tränen reizendem, erstickendem Geruch und beißendem, laugigem Geschmack; F. -77,4 °C, Kp. -33,35 °C, krit. Temp. 132,5 °C, krit. Druck 11,25 MPa, krit. D. 0,235 g cm-3, D. des flüssigen A. bei -34,4 °C 0,683 g cm-3, bei 0 °C 0,639 g cm-3, Dampfdruck bei 0 °C 0,438 MPa, bei 30,0 °C 1,19 MPa, Verdampfungswärme des flüssigen A. bei -33,35 °C 1372,0 kJ/kg, bei 0 °C 1264,3 kJ/kg und bei 32,2 °C 1137,3 kJ/kg. In festem Zustand bildet A. farblose, kubische Kristalle.
Eigenschaften. Das Ammoniakmolekül hat pyramidale Struktur, der H-N-H-Winkel beträgt 107,3°. Daraus kann man auf weitgehende sp3-Hybridisierung am N-Atom schließen. Die NH3-Pyramide ist nicht stabil, sondern unterliegt auch bei tiefer Temperatur rascher Inversion. Die Höhe der Inversionsbarriere beträgt 24,8 kJ/mol. Die hohe Polarität der NH3-Moleküle und die Ausbildung starker Wasserstoffbrückenbindungen bewirken, daß flüssiges A. beträchtlich assoziiert ist (Dielektrizitätskonstante bei -50 °C 22,7).
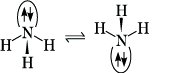
Ammoniak. Abb. 1: NH3-Pyramide.
Dies ist die Ursache des unerwartet hohen Siedepunktes und der hohen Verdampfungsenthalpie des A.
A. vermag als Folge seiner Molekülstruktur sowohl mit Donor- als auch Akzeptormolekülen in Wechselwirkung zu treten, d. h., es ist z. B. in der Lage, sowohl Anionen als auch Kationen eines Salzes zu solvatisieren. Dies verschafft dem flüssigen A. ähnliche Lösungsmitteleigenschaften wie dem Wasser. So sind zahlreiche anorganische und organische Verbindungen in flüssigem A. gut löslich. Flüssiges A. unterliegt ähnlich dem Wasser der Autoprotolyse : 2 NH3
![]()
NH2- + NH4+. Alkalimetalle sowie Calcium, Strontium und Barium lösen sich in flüssigem A. unter Bildung tiefdunkelblauer Lösungen, deren elektrische Leitfähigkeit und deren Paramagnetismus auf das Vorliegen solvatisierter Elektronen zurückgeführt wird:
A. löst sich begierig in Wasser. 100 ml Wasser lösen bei 0 °C 90,7 g, d. s. 117,6 l gasförmiges A., bei 100 °C 7,4 g A.; Lösungsenthalpie des gasförmigen A. bei 25 °C 30,64 kJ/mol.
Die Hauptmenge des A. ist in Wasser molekular gelöst. Infolge der Fähigkeit des A., als Protonenakzeptor zu fungieren, erfolgt in geringem Umfang Protolyse: NH3 + H2O
![]()
NH4+ + OH- (pKB = 4,75). Die wäßrige Lösung reagiert deshalb basisch. Durch Einwirkung starker Basen auf Ammoniumsalze wird A. wieder freigesetzt, z. B. NH4Cl + NaOH → NH3 + NaCl + H2O. Gegenüber sehr starken Basen, wie Metallorganica oder ionischen Hydriden, vermag A. als Säure zu fungieren und geht in seine korrespondierende Base, das Amid-Ion NH2-, über. Amide werden auch bei Einwirkung elektropositiver Metalle auf A. bei erhöhter Temperatur gebildet, z. B. Na + NH3 → NaNH2 + 1/2 H2.
Das bei gewöhnlicher Temperatur beständige A. zerfällt beim Erwärmen in Gegenwart bestimmter Katalysatoren bis zur Gleichgewichtskonzentration in die Elemente: 2 NH3
![]()
N2 + 3 H2, ΔH = 92,5 kJ/mol. In reinem Sauerstoff verbrennt A. im wesentlichen zu Stickstoff und Wasser: 2 NH3 + 3/2 O2 → N2 + 3 H2O. A.-Sauerstoff-Gemische sind in den Grenzen von 13,5 bis 82 Vol.-% A. und A.-Luft-Gemische von 15,5 bis 28 Vol.-% A. explosibel. Nimmt man die Verbrennung in Gegenwart von Platin- oder Platin-Rhodium-Katalysatoren vor, so erfolgt Umsetzung zu Stickstoffmonoxid: 4 NH3 + 5 O2 → 4 NO + 6 H2O, ΔH ≈ -900 kJ/mol. Diese Reaktion ist die Basis des Ostwald-Verfahrens zur Herstellung von Salpetersäure. Vermöge seines freien Elektronenpaares ist A. ein guter Komplexligand und ein starkes Nucleophil.
|
Analytisches. Der qualitative Nachweis des A. erfolgt durch Bildung des blauen [Cu(NH3)4]2+-Komplexes oder durch Neßlers Reagens.
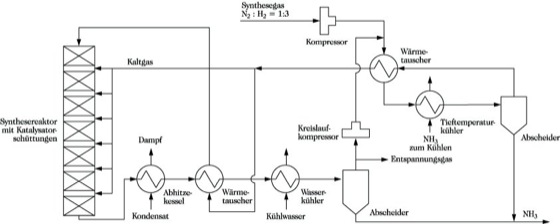
Ammoniak. Abb. 2: Schema einer Ammoniakerzeugungsanlage.
Vorkommen. A. ist das biologische Abbauprodukt zahlreicher organischer Stickstoffverbindungen und kommt im Ergebnis der Verwesung pflanzlichen und tierischen Materials, üblicherweise in Form von Ammoniumsalzen, in der Natur vor. Auch einige Minerale enthalten geringe Mengen A.
Gewinnung. A. wird heute nahezu ausschließlich durch direkte Vereinigung der Elemente Stickstoff und Wasserstoff nach dem Prinzip des Haber-Bosch-Verfahrens gewonnen. Die Umsetzung N2 + 3 H2
![]()
2 NH3, ΔH = -92,5 kJ/mol, bedarf infolge der hohen Dissoziationsenthalpie des N2-Moleküls energischer Aktivierung. Der exotherme Charakter der Reaktion begrenzt jedoch eine thermische Anregung, weil sich die Gleichgewichtslage mit steigender Temperatur nach links verschiebt. Es wurden deshalb Katalysatoren entwickelt (Eisenoxide mit geringen Anteilen Aluminium-, Calcium-, Kalium-, Magnesium- und Titandioxid u. a. als Promotoren, die nach Reduktion durch Wasserstoff in die aktive Form des α-Eisens übergehen), mit denen bei Reaktionstemperaturen um 400 °C technisch verwertbare Umsätze erreicht werden.
Abb. 2 zeigt das Schema einer Ammoniakerzeugungsanlage. Das Synthesegas mit der Zusammensetzung Stickstoff : Wasserstoff = 1 : 3 wird durch Wärmeaustausch mit dem bereits umgesetzten Gas auf die Arbeitstemperatur des Katalysators (400 bis 500 °C) vorgeheizt und dem Synthesereaktor zugeführt. Nach jeder Katalysatorschicht wird durch Zuführung von Kaltgas wieder auf die optimale Arbeitstemperatur des Katalysators abgekühlt. Nach etwa der 5. bis 10. Katalysatorschicht ist die Gleichgewichtszusammensetzung erreicht. Nach Passieren eines Abhitzekessels, eines Wärmetauschers zur Vorwärmung des Einsatzgases und eines Wasserkühlers scheidet sich ein Teil des A. ab. Die vollständige Entfernung aus dem Kreislaufgas erfolgt in einem mit A. gefüllten Tiefkühler. Das nicht umgesetzte Gas wird zusammen mit dem Frischgas erneut dem Reaktor zugef'ührt. Für den Ausgleich des Druckverlustes sorgt ein Kreislaufkompressor. Durch ständiges Entspannen eines Teilstromes wird verhindert, daß sich Inertgase (Argon und Methan) im Kreislaufgas anreichern. Aus diesen Entspannungsgasen kann Argon gewonnen werden.
Im Laboratorium stellt man A. durch Einwirkung starker Basen auf Ammoniaksalze her.
A. kommt verflüssigt in Stahlflaschen oder in Wasser gelöst als 25-30%iges konz. A. (Ammoniakwasser, Trivialname Salmiakgeist) in den Handel.
Verwendung. A. ist die Basis nahezu aller technisch hergestellter Stickstoffverbindungen. Der größte Anteil des produzierten A. wird zur Herstellung von Stickstoffdüngemitteln verwendet. Auch als Ausgangsprodukt zur Gewinnung von Harnstoff oder Ammoniumsulfat kommt A. letztlich in der Landwirtschaft zur Anwendung. A. dient zur Herstellung von Soda, Salpetersäure, verschiedenen Ammoniumsalzen, Natriumcyanid, Blausäure, Hydrazin, Nitrilen, Aminen, Amidharzen, Chemiefasern, Farbstoffen, Sprengstoffen u. a. Es wird in der Kältetechnik und in der Metallurgie (zur Nitrierhärtung) eingesetzt. Ammoniakwasser wird in der Bleicherei, in der Färberei, beim Lichtpausverfahren und allgemein als billige Base verwendet.
Schreiben Sie uns!