Lexikon der Chemie: Kupfer
Kupfer, Symbol Cu, chem. Element aus der 1. Nebengruppe des Periodensystems, der Kupfergruppe, Schwermetall; Z 29, Massenzahlen der natürlichen Isotope 63 (69,17 %), 65 (30,83 %), Atommasse 63,546, Wertigkeit I, II, seltener III, IV, Härte nach Mohs 3, D. 8,92 g cm-3, F. 1083 °C, Kp. 2595 °C, elektrische Leitfähigkeit 59,5 Sm/mm2, Standardelektrodenpotential (Cu/Cu2+) +0,337 V.
Eigenschaften. K. ist ein hellrotes, weiches, aber zähes und sehr dehnbares Metall, das man leicht zu feinen Drähten ausziehen kann. Es kristallisiert regulär, in kubisch dichtester Kugelpackung. K. weist unter allen Metallen nach Silber die beste elektrische Leitfähigkeit und Wärmeleitfähigkeit auf; es stellt außer Gold das einzige metallene Element mit charakteristischer Eigenfarbe dar. Als typisches Übergangsmetall bildet es farbige Verbindungen und zeigt eine ausgeprägte Neigung zur Komplexbildung. Die Besetzung der äußeren Elektronenschalen 3d10, 4s1 bedingt die Bildung von Kupfer(I)-Ionen mit abgeschlossener 3d10-Besetzung, während Kupfer(II)-Ionen eine 3d9-Konfiguration aufweisen.
Entsprechend seiner Stellung in der elektrochem. Spannungsreihe und der verhältnismäßig niedrigen Bildungswärme seiner Oxide ist K. ein relativ edles Metall. So wird es an der Luft nur sehr langsam oberflächlich zu rotem Kupfer(I)-oxid oxidiert. In Gegenwart von Kohlendioxid oder Schwefeldioxid (z. B. aus der Atmosphäre) bilden sich Überzüge von grünem basischem Carbonat CuCO3 ·Cu(OH)2, oder basischem Sulfat CuSO4 ·Cu(OH)2 (Patina), die das darunter liegende Metall vor weiterer Zerstörung schützen. Als relativ edles Metall wird K. nur durch oxidierende Säuren, z. B. Salpetersäure, angegriffen; unedle Metalle, wie Eisen, Zink oder Magnesium, scheiden K. aus seinen Salzlösungen ab. Bei erhöhter Temperatur wird K. durch Sauerstoff und Halogene oxidiert. In charakteristischer Weise greifen Schwefel und Schwefelverbindungen K. an, wobei sich Oberflächenschichten von Kupfersulfiden bilden.

Kupfer. Abb.1: Schema pyrometallurgischer Verarbeitungsvarianten für sulfidische Kupfererze und -konzentrate. I flotierbare Kupfererze, II nicht flotierbare Kupfererze, III Standardverfahren, IV Röstschmelzverfahren.
Analytisches. Kupferverbindungen verleihen der Bunsenflamme eine charakteristische grüne Farbe. Aus schwach saurer Lösung werden Cu2+-Ionen als schwarzes Kupfer(II)-sulfid CuS gefällt. Zum Nachweis sowie zur kolorimetrischen Bestimmung von Kupfer(II) wird der tiefblaue Komplex herangezogen, der sich bei Zugabe von Ammoniak zu wäßrigen Kupfer(II)-salzlösungen bildet: [Cu(NH3)4(H2O)2]2+. Gelbes Blutlaugensalz ergibt mit Cu2+ einen charakteristischen rotbraunen Niederschlag: Kupfer(II)-hexacyanoferrat(II) Cu2[Fe(CN)6]. Zur quantitativen Bestimmung wird die Elektrogravimetrie (Abscheidung von K. aus schwefel- oder salpetersaurer Lösung bei 1,7 bis 2,5 V an einer Platinkathode) eingesetzt, auch kupferionensensitive Elektroden finden zunehmend Anwendung. Der volumetrischen Bestimmung von Cu2+ dient die Reaktion mit Iodid-Ionen zu Kupfer(I)-iodid CuI und Iod, wobei letzteres mit Thiosulfat (Iodometrie) zurücktitriert wird.
Kupfer wirkt in Form seiner Ionen Cu2+ auf niedere Organismen als starkes Gift. So sterben z. B. Bakterien und Fäulniserreger in Wasser, das sich in einem Kupfergefäß befindet, rasch ab, verhindern Kupferverbindungen Algenwachstum.
Vorkommen. K. ist am Aufbau der Erdkruste mit 10-2 % beteiligt. Neben selten gewordenen gediegenen Vorkommen dominieren Kupfererze sulfidischer Natur wie Chalkopyrit (Kupferkies) CuFeS2, Bornit (Buntkupferkies) Cu5FeS4/Cu3FeS3 und Chalkosin (Kupferglanz) Cu2S. Wirtschaftliche Bedeutung haben auch oxidische Vorkommen wie Cuprit (Rotkupfererz) Cu2O, ferner der grüne Malachit CuCO3 ·Cu(OH)2, und der blaue Azurit (Kupferlasur) Cu3(OH)2(CO3)2. Der Durchschnittskupfergehalt der heute in der Welt abgebauten Kupfererze liegt bei etwa 1,5 bis 2 %.
K. ist für Mensch, Tier und Pflanze ein lebenswichtiges Spurenelement. Der menschliche Körper enthält etwa 100 bis 150 mg Cu. K. ist in der Biosphäre vor allem an Elektronenübertragungsreaktionen beteiligt. Es ist für die Chlorophyllsynthese der Pflanzen erforderlich und nimmt als Bestandteil mehrerer Enzyme auch am Aufbau des Hämoglobins teil. Im Blut von Weichtieren und Krebsen des Meeres übernimmt kupferhaltiges Hämocyanin anstelle von Hämoglobin die Funktion des Sauerstoffüberträgers. Auch im menschlichen Blut ist eine Reihe – häufig blau gefärbter – Kupferproteine enthalten. Ferner kann K. an organspezifischen Eiweißen gebunden vorliegen.
Gewinnung. K. wird meist auf pyrometallurgischem Wege aus Sulfidkonzentraten gewonnen, die durch flotative Erzanreicherung erhalten werden. Eine weitere metallurgische Konzentrierung erfolgt durch Erschmelzen eines Kupfersteins, woran sich die Röstreduktionsreaktion zum Rohkupfer anschließt, das elektrolytisch gereinigt wird.
Die durch Flotation erhaltenen Sulfidkonzentrate enthalten bis zu 30 % K. Oxidische Erze, z. B. CuCO3, Cu(OH)2 werden hauptsächlich hydrometallurgisch verarbeitet.
1) Pyrometallurgische Gewinnung von Rohkupfer.
In der ersten metallurgischen Verarbeitungsstufe der Sulfidkonzentrate werden der Kupferstein für die Röstreaktion gewonnen und eine kupferarme Schlacke erzeugt (bis 0,5 % Cu). Für die Erschmelzung des Kupfersteins, der 38 bis 50 % Kupfer, 22 bis 33 % Eisen und 24 bis 26 % Schwefel enthält, wird durch Vorrösten das angestrebte Cu:S-Verhältnis eingestellt und das Einschmelzen in Flammöfen bei 1200 bis 1400 °C unter Zusatz von Kalk und Sand als Schlackebildner vorgenommen. Der Kupferstein und die sich darüber abscheidende Kupferschlacke mit etwa 35 % SiO2, 40 % FeO und 5 % CaO werden getrennt abgestochen. Röstschmelzverfahren, bei denen die Exothermie der Sulfidabröstung in einem Schwebeschmelzofen für den Schmelzprozeß ausgenutzt wird, arbeiten energiegünstiger. Die dabei entstehenden kupferreichen Schlacken werden in Elektroöfen entkupfert. Sulfiderze, die sich nicht durch Flotation aufbereiten lassen, werden nach dem Schachtofenschmelzverfahren verarbeitet (Einschmelzen eines Erz-Koks-Möllers). Neben dem Kupferstein wird eine große Menge an Schlacke gebildet.
Während beim Erschmelzen des Kupfersteins Zink- und Bleiverbindungen verflüchtigt und im Flugstaub abgeschieden werden, sammeln sich Edelmetalle und Nickel im Stein an.
Zur Gewinnung des Rohkupfers wird der schmelzflüssige Kupferstein in Trommelkonvertern einem Röstreaktionsprozeß unterworfen, wobei durch Lufteinblasen durch den Konverterboden das Kupfer(I)-sulfid partiell in Kupfer(I)-oxid umgewandelt wird, das mit weiterem Sulfid nach 2 Cu2O + Cu2S → 6 Cu + SO2 zum K. reagiert (Konvertierung). Aus dem Eisensulfid entstehen durch den Röstprozeß mit den SiO2-Zuschlägen silicatische, kupferreiche Schlacken, die als Zuschlagstoffe beim Steinschmelzen dienen. Der Kupfergehalt im Rohkupfer beträgt 97 bis 99 %. Aus dem Schwefeldioxid wird Schwefelsäure gewonnen.
2) Raffination von Rohkupfer. Ein Teil der Verunreinigungen im Rohkupfer, insbesondere Eisen, Zink, Zinn, Blei, Arsen und Antimon, wird durch selektive Oxidation in Flammöfen mit Luft durch Verschlackung und Verflüchtigung beseitigt (Vorraffination), da sonst die elektrolytische Raffination ungünstig beeinflußt wird. Die Elektrolyse erfolgt bei 50 °C mit einem schwefelsauren Kupfersulfatelektrolyten. Von den in den vorraffinierten Anoden verbliebenen Verunreinigungen sammelt sich die Hauptmenge an Gold, Silber, Selen, Tellur, Blei und Antimon im Anodenschlamm an, während sich der größte Teil des Nickels und Arsens im Elektrolyten anreichert, der deshalb regeneriert werden muß (elektrolytische Entkupferung). Aus dem Anodenschlamm werden die Edelmetalle und das Selen gewonnen. Das Kathodenkupfer weist Kupfergehalte von etwa 99,95 % auf.
3) Hydrometallurgische Kupfergewinnung (Abb.2). Oxidische und oxidisch-sulfidische Erze sowie Haldenprodukte mit Kupfergehalten von 1,5 bis 0,4 % lassen sich bevorzugt mit Schwefelsäure bzw. Eisen(III)-sulfatlösung auslaugen. Aus den kupferarmen Lösungen läßt sich in Trommeln das K. durch Zementation mit Eisenschrott ausscheiden, als Zementkupfer von der Lösung abtrennen und zu Rohkupfer umschmelzen. Kupferreiche Laugen (30 bis 40 g Cu/l) können direkt einer Gewinnungselektrolyse unterworfen werden. Die hydrometallurgische Gewinnung kann auch durch Flüssig-Flüssig-Extraktion mit Hydroxidoximen in Benzin erfolgen, wobei die kupferarme Primärlauge konzentriert und gereinigt wird und so der Elektrolyse zugeführt werden kann.
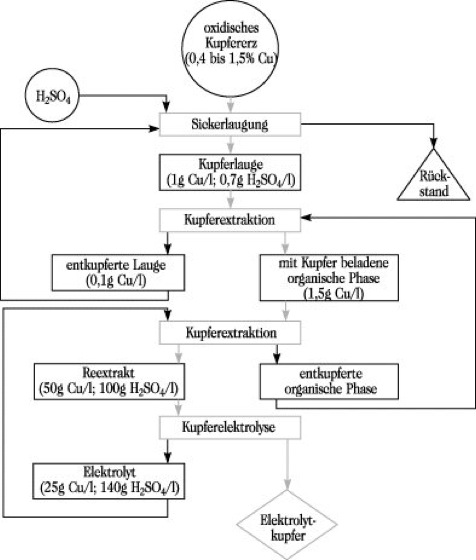
Kupfer. Abb. 2: Schema der hydrometallurgischen Kupfergewinnung aus oxidischen Erzen.
Verwendung. Aufgrund seiner hervorragenden Eigenschaften, d. s. hohe elektrische und thermische Leitfähigkeit, gute Verformbarkeit und Legierungsfähigkeit, hohe Korrosionsbeständigkeit, leichte galvanische Abscheidbarkeit und ansprechende Farbe, stellt K. das am häufigsten verwendete Nichteisenschwermetall dar. Mehr als die Hälfte der Weltproduktion an metallenem K. geht in die Elektroindustrie, vor allem zur Herstellung von Leitungen sowie in den Schalter-, Generatoren-, Motoren- und Transformatorenbau. Reines K. wird ferner zur Herstellung von Behältern und Rohren, Wärmeaustauschern, Apparaturen für die chem. Industrie, die Nahrungsmittel- und Getränkeindustrie verwendet. K. dient zur Herstellung von Haushaltgeräten, zur Münzenfertigung und zur Dachabdeckung. In sehr ausgedehntem Maße wird K. zur Gewinnung von Kupferlegierungen herangezogen, die vor allem zur Halbzeugfertigung eingesetzt werden. Etwa 2 % der Weltkupferproduktion werden zu Kupferverbindungen verarbeitet, für die ein breites Einsatzspektrum charakteristisch ist.
Schreiben Sie uns!