Lexikon der Chemie: Monosaccharide
Monosaccharide, monomere Vertreter der Kohlenhydrate. M. können in Polyhydroxyaldehyde (Aldosen) und Polyhydroxyketone (Ketosen) eingeteilt werden. M. sind farblose, häufig schwer kristallisierende, optisch aktive Substanzen von meist schwach süßem Geschmack, die in Wasser leicht, in Ethanol schwer löslich sind.
Nomenklatur. Die systematischen Namen der Aldosen enden auf -ose, die der Ketosen auf -ulose. Nach der Anzahl der C-Atome teilt man die M. in Triosen, Tetrosen, Pentosen, Hexosen, Heptosen ... ein. Die einfachsten M. sind Glycerinaldehyd und Dihydroxyaceton. Für die Bezeichnung der Aldosen sind bis zu den Hexosen Trivialnamen gebräuchlich (Abb. 1).
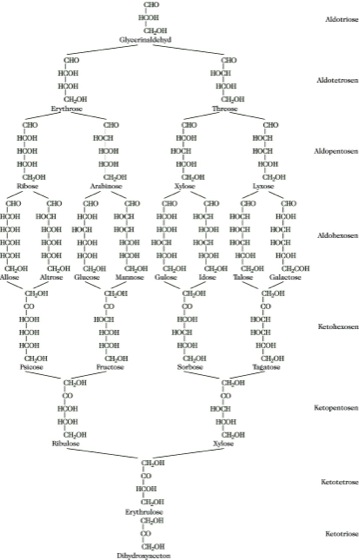
Monosaccharide. Abb. 1: Trivialnamen und Strukturen.
Die Numerierung der C-Atome erfolgt so, daß die Carbonylgruppe die kleinste Zahl erhält, also C 1 bei den Aldosen. Für die Bildung systematischer Namen, z. B. für längerkettige M., sind zur Bezeichnung der relativen Konfiguration nach der Anzahl der chiralen C-Atome folgende Präfixe gebräuchlich: 1) glycero, 2) erythro, threo, 3) arabino, lyxo, ribo, xylo, 4) allo, altro, galacto, gluco, gulo, ido, manno, talo.
Struktur. M. liegen im allg. in einer cyclischen Form vor. Sie kommt zustande durch den nucleophilen Angriff einer sterisch günstig stehenden Hydroxygruppe -OH an der Carbonylgruppe -CO unter Bildung eines Halbacetals. Die Bildung des Halbacetals ist auch der Grund dafür, daß von den M. einige typische Carbonylreaktionen, wie die Reaktion mit fuchsinschwefliger Säure oder die Anlagerung von Natriumhydrogensulfit, nicht gegeben werden. Das Gleichgewicht zwischen offenkettiger und cyclischer Form wird oxo-cyclo-Tautomerie genannt. Die OH-Gruppe des Halbacetals wird als anomer oder glycosidisch bezeichnet, die beiden Stellungen am neuen Chiralitätszentrum als α und β. Das α-Anomer ist die Verbindung, bei der die anomere OH-Gruppe die gleiche Konfiguration hat wie das für die Zuordnung zur D- oder L-Reihe herangezogene Referenz-C-Atom. Nach der Ringgröße unterscheidet man Pyranosen (Präfix Pyranosyl) und Furanosen (Präfix Furanosyl) (Abb. 2). Bei Verbindungen mit mehr als 4 Chiralitätszentren werden zwei oder mehr dieser Präfixe benutzt. Durch die vorhandenen Chiralitätszentren sind die M. und ihre Derivate optisch aktiv.
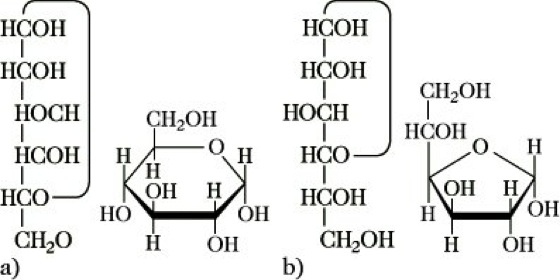
Monosaccharide. Abb. 2: α-D-Glucopyranose (a) und α-D-Glucofuranose (b), jeweils nach Fischer (links) und nach Haworth (rechts) dargestellt.
Die Darstellung der Struktur erfolgt nach Fischer oder Haworth. Nach der Fischer-Projektion steht das Atom mit der höchsten Oxidationszahl oben. Die C-C-Bindungen übereinander angeordneter C-Atome zeigen hinter die Zeichenebene, die rechts und links angeordneten Substituenten vor die Zeichenebene. Die Zuordnung zur D- oder L-Reihe richtet sich nach der Stellung der OH-Gruppe an dem von der CO-Gruppe am entferntesten stehenden chiralen C-Atom (Referenz-C-Atom). Bei der cyclischen Schreibweise nach Haworth liegt die Ringebene senkrecht zur Papierebene, während die Substituenten ober- bzw. unterhalb der Ringebene angebracht sind.
Die Anomeren können über die offenkettige Form ineinander übergehen. Bei dieser Anomerisierung kann gleichzeitig eine Veränderung der Ringgröße eintreten. Diese strukturellen Veränderungen äußern sich in einer Veränderung der optischen Drehung (Mutarotation).
Das basenkatalysierte Tautomeriegleichgewicht ist Grundlage von Umlagerungen. Als Zwischenprodukt wird ein Endiol mit sp2-hybridisiertem C-Atom gebildet. Dadurch kann es sowohl zu einem Konfigurationswechsel an dem zur CO-Gruppe benachbarten C-Atom kommen (Epimerisierung) als auch zu einer Wanderung der Carbonylgruppe (Isomerisierung). Ein Beispiel für eine Epimerisierung ist die Umlagerung Glucose
![]()
Mannose. Beide Aldohexosen unterscheiden sich nur durch die Konfiguration am C2-Atom. Die Isomerisierung ist eine Umwandlung Aldose
![]()
Ketose, z. B. Glyceraldehyd
![]()
Dihydroxyaceton (Lobry-de-Bruyn-van-Ekenstein-Umlagerung) oder Glucose
![]()
Fructose. In wäßriger Lösung finden Epimerisierung und Isomerisierung gleichzeitig statt. Enzymatisch katalysierte Isomerisierungen und Epimerisierungen spielen im Kohlenhydratstoffwechsel eine große Rolle, so die Umlagerungen Glucose
![]()
Fructose, Arabinose
![]()
Ribulose oder Ribulose
![]()
Xylulose.
Chem. Veränderungen. Beim Fehlen einer oder mehrerer OH-Gruppen spricht man von Desoxyzuckern, beim Austausch einer oder mehrerer OH-Gruppen durch Aminogruppen -NH2 von Aminozuckern. Die M. sind durch die potentielle CO-Gruppe bzw. glycosidische OH-Gruppe sowie die primären und sekundären OH-Gruppen polyfunktionelle Verbindungen. Bei Ersatz der glycosidischen OH-Gruppe durch einen Alkoholat- oder Phenolatrest entstehen die Glycoside. Die OH-Gruppen der M. können die typischen Reaktionen der Alkohole geben, also z. B. Ester (Zuckerester) oder Ether bilden. Die acylierten Glycosylhalogenide dienen als Ausgangsprodukte für Glycosidsynthesen (Glycoside). Mit Aldehyden oder Ketonen werden Acetale (z. B. mit Benzaldehyd Benzylidenverbindungen) bzw. Ketale (z. B. mit Aceton Isopropylidenverbindungen) gebildet. Durch intramolekulare Wasserabspaltung zwischen einer alkoholischen und einer glycosidischen OH-Gruppe entstehen die Zuckeranhydride, zwischen zwei alkoholischen OH-Gruppen die Anhydrozucker. Durch Kondensationsreaktion der CO-Gruppe können z. B. Oxime (mit Hydroxylamin) oder Hydrazone (z. B. mit Phenylhydrazin) gebildet werden. Bei einem pH > 4 bis 5 reagieren Aldosen und Ketosen mit drei Mol Phenylhydrazin unter Bildung der Osazone. Durch terminale Oxidation leiten sich von den M. die Aldonsäuren (Oxidation an der CO-Gruppe), Uronsäuren (Oxidation an der primären OH-Gruppe) und Aldarsäuren (Oxidation an der CO-Gruppe und der primären OH-Gruppe) ab. Die Periodatoxidation führt zu einer C-C-Spaltung. Durch Reduktion der CO-Gruppe erhält man Alditole.
Analytisches. Bei den Nachweis- und Bestimmungsmethoden unterscheidet man Reduktionsproben und Farbreaktionen. 1) Bei den Reduktionsproben wird das M. z. B. zur Onsäure oxidiert, und ein zugesetztes Oxidationsmittel wird reduziert (Tab. 1). Einige dieser Methoden eignen sich auch zur quantitativen Bestimmung der M. 2) Die Farbreaktionen laufen über die Bildung von Furfuralderivaten ab. Durch Mineralsäuren entstehen unter Wasserabspaltung aus Pentosen Furfural, aus Hexosen 5-Hydroxymethylfurfural. Furfuralderivate bilden in Gegenwart von Säuren mit verschiedenen Reagenzien gefärbte Kondensationsprodukte, die photometrisch erfaßt werden können (Tab. 2). Einige dieser Reaktionen konnten relativ spezifisch für bestimmte M. gestaltet werden.
Monosaccharide. Tab. 1: Zuckernachweis durch Reduktion von Metall-Ionen
| |||
| Cu(II) → Cu(I) | CuSO4/Tartrat/OH- CuSO4/OH- CuSO4/Citrat/OH- | Fehling-Probe Trommer-Probe Benedict-Probe | |
| Ag(I) → Ag | [Ag(NH3)2]+ | Tollens-Probe | |
| Bi(III) → Bi | Bi(III)/Tartrat/OH- | Nylander-Probe | |
| Fe(III) → Fe(II) | K3[Fe(CN)6] | Hagedorn-Jensen-Probe |
Monosaccharide. Tab. 2: Farbreaktionen von Zuckern über Furfuralderivate
| |||
| aktive Methylengruppen | Anthron/H2SO4 | Anthron-Reaktion | |
| Phenole | Orcinol/HCl/Fe3+ α-Naphthol/H2SO4 | Bial-Reaktion Molisch-Reaktion | |
| SH-Verbindungen | Cystein/H2SO4 | Dische-Reaktion | |
| aromatische Amine | Anilinphthalat o-Toluidin |
Vorkommen. Am verbreitetsten in der Natur sind die Aldohexosen D-Glucose, D- und L-Galactose und D-Mannose, die Aldopentosen D-Ribose, D-Xylose und L-Arabinose sowie von den Ketosen die D-Fructose. Intermediate im Kohlenhydratstoffwechsel sind die D-Xylulose, D-Ribulose und D-Sedoheptulose. In Mikroorganismen und Pflanzen wurden auch einige verzweigte M. gefunden.
Schreiben Sie uns!