Lexikon der Chemie: elektrische Leitfähigkeit
elektrische Leitfähigkeit, Maß für die Fähigkeit eines Stoffes, elektrische Ladungen zu transportieren. Werden Elektronen transportiert, handelt es sich um Leiter I. Ordnung (Elektronenleiter); werden Ionen transportiert, um Leiter II. Ordnung (Ionenleiter). Mischleiter zeigen beide Arten des Ladungstransportes.
Die e. L. ist temperaturabhängig. Für Elektronenleiter nimmt sie mit steigender Temperatur ab, für Ionenleiter steigt sie bei Temperaturerhöhung an. Quantitative Angaben zur e. L. beziehen sich daher stets auf eine bestimmte Meßtemperatur.
Die e. L. ist der reziproke Wert des elektrischen Widerstandes. Ihre SI-Einheit ist das Siemens (S = Ω-1). Analog bezeichnet man den reziproken Wert des spezifischen Widerstandes als spezifische Leitfähigkeit κ. Diese läßt sich aus dem elektrischen Widerstand R wie folgt berechnen:
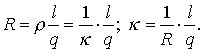
Hierbei bedeuten ρ den spezifischen Widerstand, l die Länge und q den Querschnitt des Leiters. Für Ionenleiter wird die Dimension der spezifischen Leitfähigkeit mit Ω-1cm-1 angegeben, bei metallischen Leitern sind außerdem noch die Einheiten Ω-1mm-1 und Ω-1m mm-2 gebräuchlich.
Die spezifische Leitfähigkeit metallischer Leiter liegt zahlenmäßig einige Zehnerpotenzen höher als die von Ionenleitern. Sie beträgt bei 20°C z. B. für:
Kupfer 59·10-4 Ω-1cm-1
Aluminium 40·10-4 Ω-1cm-1
Eisen 10·10-4 Ω-1cm-1
Quecksilber 1·10-4 Ω-1cm-1
Besteht der Ionenleiter aus einer Elektrolytlösung, so spricht man von elektrolytischer Leitfähigkeit. Die spezifische Leitfähigkeit ergibt sich hierbei aus dem Widerstand der Elektrolytlösung zwischen zwei Elektroden mit einem Abstand l = 1 cm und einem Querschnitt q= 1 cm2. Sie beträgt für 1 molare Lösungen bei 18°C z. B. für:
Kaliumchlorid 0,0982 Ω-1cm-1
Salzsäure 0,3010 Ω-1cm-1
Essigsäure 0,0013 Ω-1cm-1
Silbernitrat 0,0676 Ω-1cm-1
Die spezifische Leitfähigkeit ist eine Funktion der Konzentration. In verd. Lösungen ist sie annähernd proportional der Konzentration. Mit steigender Konzentration durchläuft sie ein Maximum und sinkt anschließend kontinuierlich ab. Ursache für dieses Absinken ist bei starken Elektrolyten eine gegenseitige Behinderung der Ionen (Debye-Hückel-Theorie), bei schwachen Elektrolyten die Verringerung des Dissoziationsgrades.
Da die spezifische Leitfähigkeit von der Elektrolytkonzentration abhängt, ist es günstiger, eine auf die Elektrolytmenge bezogene Leitfähigkeit zu definieren. Die auf die Stoffmengenkonzentration in mol/l bezogene Leitfähigkeit ist die molare Leitfähigkeit Λm. Sie gibt den Leitfähigkeitsbeitrag von 1 Mol gelösten Elektrolyten an, der sich zwischen zwei genügend großen Elektroden des Abstandes 1 cm befindet. Die spezifische Leitfähigkeit κ und die molare Leitfähigkeit Λm sind über die Beziehung Λm = κ/c Ω-1mol-1m2 miteinander verknüpft, wobei die Konzentration in der Einheit mol l-1 angegeben wird. Bei der Division von Λm durch die Äquivalentzahl ne ergibt sich die Äquivalentleitfähigkeit Λeq: Λeq = Λm/ne = κ/(ne·c) Ω-1mol-1m2. Wegen der Abhängigkeit der spezifischen Leitfähigkeit von der Konzentration sind auch die molare Leitfähigkeit und die Äquivalentleitfähigkeit konzentrationsabhängig. Für starke Elektrolyte gilt das empirische Quadratwurzelgesetz von Kohlrausch:
. Hierbei bedeuten Λ∞ die Äquivalentleitfähigkeit bei unendlicher Verdünnung (Grenzleitfähigkeit) und keine von Viskosität und Dielektrizitätskonstante des Lösungsmittels abhängige Konstante.
Die Messung der elektrolytischen Leitfähigkeit wird analog zu Widerstandsmessungen mit Hilfe von Brückenschaltungen vorgenommen. Um eine Polarisation der Meßelektroden zu vermeiden, wird Wechselstrom angewandt. Mit Hilfe von Leitfähigkeitsmessungen können Konzentrationen bestimmt werden.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.