Lexikon der Chemie: Elektronenspinresonanz-Spektroskopie
Elektronenspinresonanz-Spektroskopie, ESR-Spektroskopie, paramagnetische Elektronenresonanz-Spektroskopie, EPR-Spektroskopie (Abk. von engl. electron paramagnetic resonance), zur Hochfrequenzspektroskopie gehörende Methode, die paramagnetische Substanzen zum Untersuchungsgegenstand hat. Mittels der E. wird der Einfluß der in den Substanzen vorhandenen inneren magnetischen und elektrostatischen Felder auf das ungepaarte Elektron untersucht. Diese Wechselwirkungen haben spezifische Spektren mit charakteristischer Linienzahl und Linienbreite zur Folge. Aus ihnen können Informationen über die Struktur, die Symmetrie, den Charakter der chem. Bindung sowie auch über chem. Gleichgewichte und Reaktionsmechanismen abgeleitet werden.
Die E. ist der NMR-Spektroskopie nahe verwandt. Ähnlich den dort untersuchten Atomkernen hat auch das ungepaarte Elektron in paramagnetischen Substanzen einen Spin (S = 1/2) und damit verknüpft ein magnetisches Moment, das in einem äußeren Magnetfeld in zwei Energiezustände aufgespalten wird, zwischen denen durch elektromagnetische Strahlung geeigneter Frequenz Übergänge induziert werden können. Die theoretischen Grundlagen der E. sind deshalb in vieler Hinsicht der der NMR-Spektroskopie analog. Das magnetische Moment eines Elektrons ist allerdings wesentlich größer als das der Atomkerne, so daß für das "Umklappen" der Elektronenspins elektromagnetische Strahlung höherer Energie (aus dem Mikrowellenbereich elektromagnetisches Spektrum) erforderlich ist. Die Resonanzbedingung, die angibt, welche Frequenz elektromagnetische Strahlung mit der paramagnetischen Substanz bei einer äußeren Feldstärke H0 in Resonanz (Energieaustausch) tritt, lautet in der E. v = (gμBH0)/h (1) wobei μB das Bohrsche Magneton, h das Plancksche Wirkungsquantum und g den g-Faktor bedeuten, dessen Größe von den Beiträgen des Elektronenspins und des Bahndrehimpulses zum magnetischen Moment abhängt (s. u.).
Aufnahmetechnik und Probenpräparation. Das Schema eines ESR-Spektrometers zeigt Abb. 1.
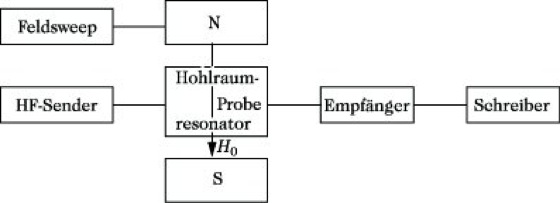
Elektronenspinresonanz-Spektroskopie. Abb. 1: Schema eines ESR-Spektrometers.
Die Probe ist in einem Resonator, der sich in einem starken homogenen Magnetfeld H0 befindet. Die Stärke des H0-Feldes kann variiert werden. Senkrecht zur Richtung von H0 wirkt ein hochfrequentes elektromagnetisches Wechselfeld auf die Probe ein. Ist die Resonanzbedingung (1) erfüllt, dann wird dem eingestrahlten Wechselfeld Energie entnommen. Diese Energieabsorption kann mit einem empfindlichen Detektor registriert werden und nach entsprechender Verstärkung entweder mittels eines Oszillographen oder mit einem Schreiber sichtbar gemacht werden. In der E. wird meist das differenzierte Signal (1. Ableitung des Absorptionssignals) aufgezeichnet (Abb. 2).
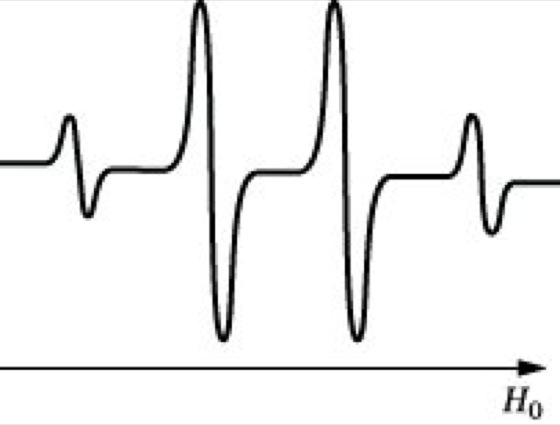
Elektronenspinresonanz-Spektroskopie. Abb. 2: ESR-Spektrum (Ableitung) des Methylradikals.
Mit der E. können Substanzen in allen Aggregatzuständen untersucht werden, vorausgesetzt, daß sie ungepaarte Elektronen enthalten. Derartige Substanzen sind Atome oder Ionen mit nicht aufgefüllten inneren Elektronenschalen (z. B. Ionen der Übergangsmetalle), Atome oder Moleküle mit ungerader Elektronenzahl (z. B. NO oder NO2), freie Radikale, Metalle, Halbleiter und Störstellen in Festkörpern. Da die meisten Stoffe diamagnetisch (Magnetochemie) sind, ist es von Bedeutung, daß viele von ihnen durch besondere Methoden der Radikalerzeugung (z. B. durch Bestrahlung oder elektrolytisch) ESR-Messungen zugänglich gemacht werden können.
Spektrenparameter und ihr Informationsgehalt. Die Signallage wird im ESR-Spektrometer entsprechend der Resonanzbedingung (1) außer durch die apparativen Größen v und H0 noch durch den g-Faktor festgelegt. Für ein "solvatisiertes Elektron", wie es z. B. in den tiefblauen Lösungen eines Alkalimetalls in flüssigem Ammoniak vorliegt, beträgt der g-Faktor 2,00232. In jeder chem. Verbindung ist das ungepaarte Elektron bestimmten inneren Feldern ausgesetzt, die sich dem H0-Feld überlagern. Daher weicht der g-Faktor einer konkreten chem. Verbindung vom g-Wert des freien Elektrons mehr oder weniger ab und ist eine substanzspezifische Größe, die formal der chem. Verschiebung in der NMR-Spektroskopie entspricht. g-Faktoren können somit Strukturinformationen liefern. In organischen Radikalen unterscheidet sich der g-Faktor meist nur geringfügig von dem des freien Elektrons (Tab.). Wenn das ungepaarte Elektron ganz oder teilweise an einem Heteroatom lokalisiert ist, weichen die g-Faktoren etwas stärker von dem des freien Elektrons ab. Wie die Tab. zeigt, können somit Kohlenstoff-, Sauerstoff- und Stickstoffradikale unterschieden werden. Dagegen können paramagnetische Metall-Ionen g-Faktoren aufweisen, die teils erheblich vom g-Faktor des freien Elektrons abweichen. Für Lanthanoiden-Ionen wurden z. B. g-Faktoren bis zu 18 gefunden, für die eine starke Spin-Bahn-Kopplung in diesen Atomen verantwortlich ist. g-Faktoren, die in Flüssigkeiten gemessen werden, sind isotrop. Untersucht man dagegen Einkristalle, so hängt der g-Faktor von der Orientierung des Kristalls zur Feldrichtung ab.
Elektronenspinresonanz-Spektroskopie. Tab.: g-Faktoren organischer Radikale.
| ||||
| C2H5· | 2,0026 | CH2=C-· O | 2,0045 | |
| CH2=CH· | 2,0022 | R-N-R |· O | 2,005 ... 2,009 |
Hyperfeinstruktur. Ihre besondere analytische Bedeutung erlangt die E. durch die Wechselwirkungen des ungepaarten Elektrons mit den magnetischen Momenten von Atomkernen, die sich in einer Hyperfeinstruktur (Hfs) zu erkennen gibt. Die Wechselwirkung kann mit dem Atomkern des gleichen Atoms erfolgen, zu dem das ungepaarte Elektron gehört, oder mit Nachbarkernen. Abstand, Anzahl und Intensität dieser Hyperfeinstrukturlinien liefern wichtige Informationen über die Struktur von Radikalen und paramagnetischen Zentren.
Kerne mit einem magnetischen Moment, die zu einer Elekronenspin-Kernspin-Wechselwirkung Anlaß geben, sind z. B. 1H, 14N , 31P, 77Se. Sie können sich analog wie die Spin- oder Bahnmomente der Elektronen in einem äußeren Magnetfeld in 2I + 1 verschiedenen Richtungen einstellen. Im einfachsten Fall treten ein ungepaartes Elektron (S = 1/2) und ein Atomkern mit der Kernspinquantenzahl I = 1/2 z. B. der 1H-Kern, miteinander in Wechselwirkung. Wasserstoffkerne können im äußeren Feld zwei verschiedene Richtungen einnehmen. Da diese beiden Orientierungen annähernd gleich wahrscheinlich sind, bedeutet dies, daß bei ungefähr der Hälfte der Wasserstoffkerne die wirksame Komponente des magnetischen Momentes in Richtung des äußeren Feldes weist, in der anderen Hälfte entgegengesetzt zur äußeren Feldrichtung orientiert ist. Ein ungepaartes Elektron ist somit nicht nur dem äußeren H0-Feld ausgesetzt, sondern auch der Wirkung eines dem H0-Feld gleich- oder entgegengerichteten zusätzlichen Feldes der Kernmagnete. Die auf das Elektron tatsächlich wirkende Feldstärke ist H0 + HKern bzw. H0 – HKern, so daß die Energie der Zeeman-Niveaus in Abhängigkeit von der Kernorientierung jeweils 2 verschiedene Werte hat. Zwischen diesen Energieniveaus kann es durch Einstrahlung von h·ν entsprechend Gl. (1) zu Übergängen kommen. Im Gegensatz zum ESR-Spektrum des freien Elektrons, das aus einem einzigen Signal besteht, kommt es jetzt zu einer Linienaufspaltung. Es sind nur Übergänge erlaubt, die den Auswahlregeln Δms = ± 1 und ΔmI = 0 entsprechen.
Der einfachste Fall einer Hfs liegt im Wasserstoffatom vor, dessen Termschema in Abb. 3 angegeben ist. Es geht daraus hervor, daß zwei Übergänge den Auswahlregeln genügen und somit 2 Hfs-Linien auftreten, deren Abstand entweder in mT (milli-Tesla) oder in Hz angegeben wird und als Kopplungskonstante bezeichnet wird. Die Kopplungskonstante ist ein Maß für die Stärke der Wechselwirkung zwischen Elektron und Kern und vom äußeren Magnetfeld unabhängig.
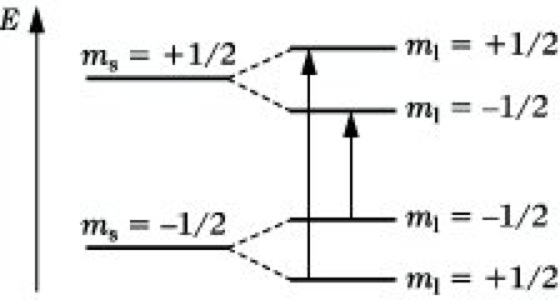
Elektronenspinresonanz-Spektroskopie. Abb. 3: Hfs-Schema für S = 1/2 und I = 1/2.
Allgemein lassen sich für die Hfs-Aufspaltung folgende Regeln angeben: 1) Befindet sich der Elektronenspin S in Wechselwirkung mit einem Kern des Kernspins I, so besteht das resultierende Multiplett aus 2I + 1 Linien. 2) Befindet sich S in Wechselwirkung mit n äquivalenten Kernen des Kernspins I, so werden 2nI + 1 Linien auftreten. 3) Bei der Wechselwirkung von S mit n Kernen der Sorte A und m hierzu nicht äquivalenten Kernen der Sorte B ergibt sich die Gesamtlinienzahl zu (2nIA + 1) *(2mIB + 1). 4) Bei Kernen mit I = 1/2 verhalten sich die Intensitäten innerhalb des Multipletts wie die Binomialkoeffizienten. Beispiel: Ein besonders einfaches ESR-Spektrum liefert das Methylradikal, das z. B. durch UV-Bestrahlung von Zn(CH3)2 erhalten werden kann. Das ESR-Spektrum besteht aus 4 Linien, wie sie entsprechend Regel 2 durch Wechselwirkung von S mit 3 äquivalenten H-Kernen (I = 1/2) zu erwarten sind. Das Intensitätsverhältnis ist entsprechend Regel 4 gleich 1 : 3 : 3 : 1 . Die Kopplungskonstante ergibt sich aus dem Abstand zweier benachbarter Linien zu 2 mT.
In Einkristallen ist die Hfs-Kopplung ebenso wie der g-Faktor anisotrop.
Signalintensitäten. Die Fläche des Absorptionssignals ist proportional der Anzahl der ungepaarten Elektronen in der Probe. Da jedoch zahlreiche apparative Faktoren die erhaltenen Intensitätswerte beeinflussen, werden praktisch kaum Absolutmessungen, sondern vorwiegend Relativmessungen durchgeführt. Dazu wird die Fläche unter dem Absorptionssignal der zu messenden Probe mit der Fläche einer Standardprobe (z. B. dem stabilen Radikal Diphenylpikrylhydrazyl DPPH) bekannter Spinzahl verglichen.
Übersicht über Anwendungsmöglichkeiten der E. Ermittlung der Struktur von freien Radikalen. Bereits aus der Anzahl der Hfs-Linien und ihrem Intensitätsverhältnis lassen sich Aussagen über die Anzahl und Äquivalenz der koppelnden Atomkerne machen. Weitergehende Informationen über die Struktur von Radikalen erhält man, wenn man die Hfs-Kopplungskonstanten berücksichtigt. Die Kopplungskonstante ist proportional der Aufenthaltswahrscheinlichkeit des ungepaarten Elektrons am betreffenden Atomkern. Da sich diese Aufenthaltswahrscheinlichkeit mit quantenchem. Methoden berechnen läßt, ergibt sich ein unmittelbarer Zusammenhang zwischen E. und theoretischer Chemie. Mit Hilfe der Hfs läßt sich die in freien Radikalen häufig vorhandene Delokalisation des ungepaarten Elektrons unmittelbar beweisen. So wird die besondere Stabilität des DPPH-Radikals auf eine Mesomerie zurückgeführt, nach der sich das ungepaarte Elektron zu gleichen Teilen an den beiden Stickstoffatomen befindet. Würde nur eine dieser Strukturen vorliegen, so käme es infolge Elektronen-Kern-Wechselwirkung mit dem N-Atom (I = 1) entsprechend den Regeln für die Multiplettaufspaltung zum Auftreten von 2i + 1 = 3 Hyperfeinstrukturlinien. Bei ungleicher Verteilung des ungepaarten Elektrons auf beide N-Atome wären (2IA + 1) · (2IB + 1) = 9 Linien zu erwarten. Die tatsächlich beobachteten 5 äquidistanten Linien im Intensitätsverhältnis 1:2:3:2:1 lassen sich nur dann erklären, wenn man eine Gleichverteilung auf beide N-Atome annimmt, da dann die beiden N-Atome gleichberechtigt sind und die Aufspaltung der Regel 2nI + 1 = 5 entspricht.
Nachweis und quantitative Bestimmung von Radikalen. Aufgrund der Proportionalität zwischen Signalintensität und Anzahl der ungepaarten Elektronen lassen sich ESR-Messungen zu quantitativen Bestimmungen paramagnetischer Substanzen verwenden. Die E. ist infolge ihres großen Nachweisvermögens – es können etwa 1011 ungepaarte Elektronen noch erfaßt werden – zum Nachweis geringster Konzentrationen paramagnetischer Substanzen geeignet, wie sie z. B. als radikalische Zwischenprodukte bei bestimmten chem. Reaktionen, aber auch in Enzymsystemen oder lebenden Geweben auftreten. Kurzlebige Radikale können mit Fließtechniken untersucht werden. Dabei mischt man die strömende Lösung der Reaktanten, deren Reaktion zur Radikalbildung führt, erst unmittelbar vor Eintritt in die Meßzelle, die als Durchflußzelle ausgebildet ist. Es lassen sich damit Radikale mit einer Lebensdauer im ms-Bereich bestimmen. Zur Identifizierung von im Reaktionsverlauf auftretenden instabilen Radikalen eignet sich auch das "spin-trapping"-Verfahren. Dabei werden die Reaktionen in Gegenwart von Radikalfängern (z. B. aromatischer oder aliphatischer Nitrosoverbindungen) durchgeführt, die mit dem eingefangenen Radikal über längere Zeit stabile Nitroxidradikale ergeben, deren ESR-Spektrum Aussagen über die Natur des instabilen Radikals erlaubt. Die Verfolgung der zeitlichen Konzentrationsänderung von Radikalreaktionen gestattet es, ihre Kinetik aufzuklären.
Anwendung in der anorganischen Chemie. Ionen und Komplexe der Übergangsmetalle und Seltenerdmetalle enthalten ungepaarte D- und f-Elektronen, so daß sie mit Hilfe der E. untersucht werden können. Ihre Spektren sind jedoch schwieriger zu interpretieren als die der freien Radikale. Durch Coulombsche Wechselwirkung zwischen den Elektronen sowie infolge Spin-Bahn-Kopplung resultieren hier g-Faktoren, die weit vom g-Faktor des freien Elektrons abweichen. Die Messungen erfolgen meist in einem geeigneten, diamagnetisch verdünnten Einkristall, um unerwünschte Wechselwirkungen zwischen den paramagnetischen Verbindungen auszuschließen. Der g-Faktor variiert mit der Orientierung des Komplexes im äußeren Feld. So beträgt er für Fe3+ im Hämoglobin 6, wenn das äußere Feld in der Ebene des Porphyrinrings liegt, und 2, wenn es senkrecht dazu angeordnet ist. Die wichtigsten Aussagen, die erhalten werden können, sind 1) die Symmetrie und Stärke des Ligandenfeldes, 2) die Art des elektronischen Grundzustandes und 3) die Delokalisation der ungepaarten Elektronen im Grundzustand und in den angeregten Zuständen. Zahlreiche Untersuchungen sind auch über die Valenzzustände der Fremdatome in Halbleitern sowie über ferromagnetische Verbindungen veröffentlicht worden.
Untersuchungen an Festkörperoberflächen. Die E. wird in den letzten Jahren in steigendem Maße zur Untersuchung von Festkörperoberflächen und von Reaktionen, die an diesen Oberflächen z. B. nach Adsorption bestimmter Atome oder Moleküle ablaufen, eingesetzt. Es können damit wertvolle Informationen über die Anwesenheit paramagnetischer Oberflächenzentren, über die Struktur gebildeter Radikale oder Übergangsmetallkomplexe, über Elektronentransfer zwischen Adsorbat und Adsorbens u. a. erhalten werden, die insbesondere im Zusammenhang mit Problemen der Adsorption und der heterogenen Katalyse von Bedeutung sind.
Schreiben Sie uns!