Lexikon der Chemie: Pyrethroide
Pyrethroide. Ausgehend von den natürlich vorkommenden Pyrethrinen wurden durch synthetische Abwandlung photostabilere und persistentere Strukturen geschaffen, die zu der bedeutenden und sehr diversifizierten Wirkstoffklasse der P. führte (s. Tab. 1). Grundbaustein ist überwiegend die Chrysanthemumsäure, die mit verschiedenen aromatischen Alkoholen verestert ist (z. B. Allethrin, Tetramethrin, Resmethrin). Sie sind bei sehr geringer Warmblütertoxizität in ihrer Wirkung den Naturprodukten gleich oder erheblich besser.
Pyrethroide. Tab. 1: Wichtige synthetische Pyrethroide.
| |||
| Allethrin | Pynamin | 585 ... 1100 | |
| Bioallethrin | Pynamin Forte | 784 ... 1545 | |
| Tetramethrin | Neo-Pynamin | > 5000 | |
| Resmethrin | Chryson, Synthrin | >2500 | |
| Bioresmethrin | 7070 ... 8000 | ||
| Permethrin | Ambush. Talcord, Dragon (Hygiene) Outflank (Veterinär) | 430 ... 4000 | |
| Bifenthrin | Talstar | 54 | |
| Cypermethrin | Cymbush. Ripcord | 250 ... 4150 | |
| Alpha-Cypermethrin | Fastac Fendona (Hygiene) Renegade (Veterinär) | 79 ... 400 | |
| Beta-Cypermethrin | Cyperil, Chinmix | 166 ... 178 | |
| Zeta-Cypermethrin | Fury | 106 | |
| Cyfluthrin | Baythroid Baygon (Hygiene) Solfac (Veterinär) | 250 ... 500 | |
| Beta-Cyfluthrin | Bulldock Responsar (Veterinär) | 270 ... 500 | |
| Deltamethrin | Decis | 135 ... 5000 | |
| Cyhalothrin | Grenade | 114 ... 166 | |
| Lambda-Cyhalothrin | Karate | 56 ... 79 | |
| Acrinathrin | Rufast | >5000 | |
| Fenvalerate | Sumicidin | 451 | |
| Esfenvalerate | Sumi-alpha | 75 ... 458 | |
| Flucythrinate | Cybolt, Cythrin | 67 ... 81 | |
| Fluvalinate | Mavrik | >3000 |

Pyrethroide. Abb. 1: Strukturbeispiel Allethrin.
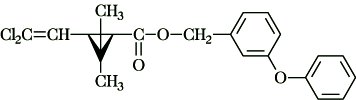
Pyrethroide. Abb. 2: Strukturbeispiel Permethrin.
Von Bedeutung war auch die Einführung der Permethrinsäure, bei der formal die Isobutenylgruppe gegen eine Dihalogenvinylgruppe ausgetauscht ist (z. B. Permethrin, Cypermethrin, Deltamethrin). Diese P. sind Berührungs- und Fraßgifte und zeigen auch im Freiland eine Wirkungsdauer von mehreren Wochen. Das Deltamethrin, mit einer mehr als 1000mal höheren Wirksamkeit als das natürliche Pyrethrin, wird in der optisch aktiven d,cis-Form hergestellt (Decis).
Wird die Cyclopropancarbonsäuregruppe durch strukturell und sterisch ähnliche, substituierte Carbonsäuren ersetzt, so resultieren zwar in der insektiziden Wirksamkeit etwas geminderte, aber im Wirkungsspektrum und den Gebrauchseigenschaften den natürlichen Pyrethrinen vielfach überlegene Verbindungen (z. B. Fenvalerate, Fluvalinate, Flucythrinate).

Pyrethroide. Abb. 3: Strukturbeispiel Fluvalinate.
Wichtige Wirkungsunterschiede zwischen den P. ergeben sich auch aufgrund einer vorhandenen oder nicht vorhandenen α-Cyano-Substitution. P. ohne α-Cyano-Substitution wie beispielsweise Bioresmethrin, Permethrin oder Tetramethrin zeichnen sich aus durch schnelles Einsetzen der Intoxikationssymptome in der Population, Koordinationsstörungen, Krämpfe und hohe Wiederholungsraten.
P. mit α-Cyano-Substitution wie beispielsweise Cyfluthrin, Cypermethrin, Cyhalothrin, Deltamethrin, Fenvalerat, Esfenvalerat oder Fluvalinat zeichnen sich aus durch langsames Einsetzen der Intoxikationssymptome in der Population, hohe Mortalität und relativ niedrige Wiedererholungsraten. Die wichtigsten Einsatzgebiete der P. sind in Tab. 2 aufgeführt.
Pyrethroide. Tab. 2: Wichtige Einsatzbereiche.
| ||
| Landwirtschaft und Gartenbau | Bekämpfung von Pflanzenschädlingen | |
| Holzschutz | Bekämpfung von Nutzholzschädlingen | |
| Vorratsschutz | Bekämpfung von Schädlingen an pflanzlichen Lebensmitteln | |
| Hygiene | Bekämpfung von Krankheitserreger-Überträgern (Vektoren), Allergen- erzeugern, Toxinerzeugern und Lebensmittelverderbern einschließlich Ekelerregern | |
| Textilschutz | Bekämpfung und Abwehr von Textilien-, Material- und Hygieneschädlingen | |
| Human- und Vetreinärtherapie | Bekämpfung und Abwehr von Ektoparasiten |
Schreiben Sie uns!