Lexikon der Chemie: Silicate
Silicate, die Salze der Kieselsäuren. S. kommen als Hauptbestandteile der Erdkruste in großer Anzahl in der Natur vor und lassen sich aus Siliciumdioxid SiO2 und Metallverbindungen auf unterschiedliche Weise synthetisieren (Silicatsynthesen). Sämtliche S. sind aus SiO4-Tetraedern aufgebaut, die meist vielfältig über Ecken (Brückensauerstoffatome) miteinander verbunden sind. Die negativen Ladungen von Trennstellensauerstoffatomen werden durch Metallkationen kompensiert. Die große Stabilität der S. erklärt sich aus stark polaren (54 % Ionenbindung) σ-Bindungen, die durch pπdπ-Doppelbindungsanteile verstärkt sind (Si-O-Si-Bindungswinkel 140 ± 5°). Nach Baugruppen werden folgende kristalline S. unterschieden (s. a:
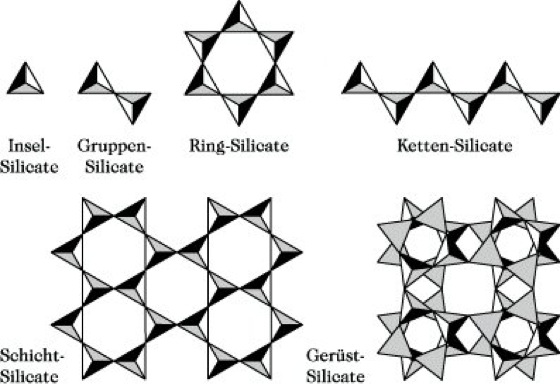
Silicate. Abb.: Anionenkomplexe der Silicate (Die jeweils vierte Ecke der SiO4-Tetraeder liegt ober- bzw. unterhalb der Zeichnungsebene; s. auch Tab.).
Durch Variation der Verknüpfungsmöglichkeiten der SiO2-Tetraeder in den hochpolymeren S. (verschiedene Identitätsperioden, Doppelringe, -ketten und -schichten; s. Abb.) und über einen Si-Ersatz durch andere Elemente (z. B. Aluminium, Alumosilicate) entsteht eine große strukturelle Vielfalt der S., die nach dem Dispersitätsgrad in grobdisperse (> 0,1 µm), feindisperse (< 0,1 µm) und molekulardisperse S. (Silicatlösungen) eingeteilt werden.
Silicate. Tab.: Die verschiedenen Arten kristalliner Silicate.
| |||
| Inselsilicate | [SiO4]4- | Forsterit Mg2SiO4 | |
| Gruppensilicate | [Si2O7]6- | Thortveitit Sc2Si2O7 | |
| Ringsilicate | [SiO3]n2n- n = 3, 4, 6 | Beryll Be3Al2Si6O18 | |
| Kettensilicate | [SiO32-]x | Wollastonit CaSiO3 | |
| Schichtsilicate | [Si2O52-]xy | Kaolinit Al4(OH)8Si4O10 | |
| Gerüstsilicate | [AlSi3O8-]xyz | Orthoklas KAlSi3O8 |
Schreiben Sie uns!