Lexikon der Ernährung: Cobalamin
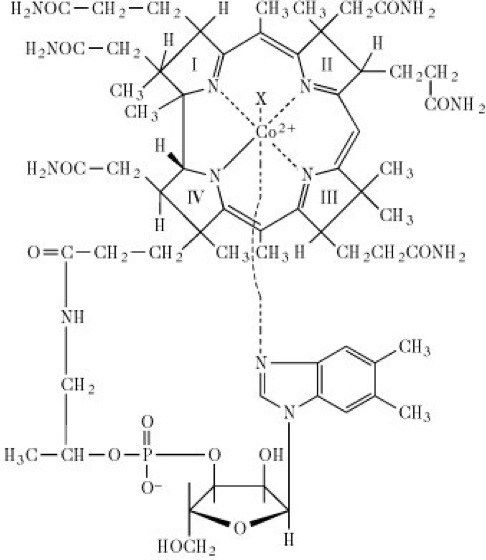
Cobalamin, Vitamin B12, Antiperniziosafaktor, Antianämiefaktor , extrinsischer Faktor, tierischer Eiweißfaktor, LLD-Faktor (Lactobacillus-lactis-Dorner-Faktor), E cobalamin, vitamin B12. Der Begriff Vitamin B12 umfasst mehrere Cobalaminverbindungen, die sich aus einem porphyrinähnlichen Makroring mit Kobalt als Zentralatom, einem Nucleotidteil und einem weiteren variablen Liganden zusammensetzen. Das beinahe flache Makroringsystem, bestehend aus vier reduzierten Pyrrolringen wird als Corrinring bezeichnet (Corrinoide). In biologischen Systemen findet man in der Regel Hydroxo-Cobalamin, Aquo-Cobalamin, Methyl-Cobalamin, oder 5’-Desoxyadenosyl-Cobalamin (Abb.), das stabile Cyanocobalamin (häufig fälschlich als Vitamin B12 bezeichnet) wurde als Präparationsartefakt identifiziert.
Eigenschaften: C. ist ein wasserlösliches Vitamin, das rote, rot-orangene oder orangene Kristalle bildet. Das Absorptionsmaximum liegt bei 300 nm. C. ist lichtempfindlich.
Vorkommen: Mikroorganismen sind die einzigen Lebewesen, die C. synthetisieren können. Bei Herbivoren reicht die enterale Synthese zur Bedarfsdeckung völlig aus. Einen hohen Gehalt findet man in Leber (40–65 µg %), mittlere Gehalte haben Fleisch (2–6 µg%), Fisch (2–9 µg%), Magermilchpulver (2,2 µg%) und Käse (1,2–2,1 µg%). Die körpereigenen Reserven reichen für 3–5 Jahre.
Bedarf (nach DGE): Der Bedarf von Erwachsenen liegt bei 5 µg / d (Schätzwert). Der Vitamin-B12-Bedarf liegt für Säuglinge bei 0,5–0,8 µg / Tag. Kinder benötigen je nach Lebensalter 1,0–3,0 µg / d.
Resorption, Metabolismus: Vitamin B12 liegt in der Nahrung sowohl in freier als auch in gebundener Form vor. Freies Vitamin B12 wird bereits im Speichel von Glycoproteinen (Haptocorrine, R-Proteine) gebunden. Das gebundene Vitamin B12 wird dann im Magen durch Pepsin freigesetzt. Bedingt durch den niedrigen pH-Wert des oberen Gastrointestinaltrakts wird der größte Teil des C. an Haptocorrin gebunden, der kleinere an den von den Belegzellen sezernierten intrinsischen Faktor (IF). Im Dünndarm spaltet Pankreas-Trypsin die Haptocorrin-Cobalamin-Verbindung und das so freigesetzte C. lagert sich an den IF an. Die Resorption von Vitamin B12 geschieht in physiologischer Dosierung über einen aktiven Mechanismus nach Bindung an den IF, unphysiologisch hohe Dosen werden in geringem Umfang durch passive Diffusion ohne vorherige Bindung aufgenommen. Mit Hilfe des IF werden maximal 1,5 µg C. resorbiert (trotz steigender Dosis) aufgrund der limitierenden Inkorporationskapazität der Darmmucosa für den Komplex aus C. und intrinsischem Faktor. Im enterohepatischen Kreislauf wird ein großer Teil, der mit der Galle ausgeschiedenen Cobalaminmenge wieder rückresorbiert. In der Darmmucosa wird Vitamin B12 an das Transportprotein Transcobalamin II gebunden und an das Blut abgegeben. Hauptspeicherorgane sind die Leber (60 %) und die Muskulatur (30 %). In der Leber erfolgt die Umwandlung in die biologisch aktiven Formen Methyl-Cobalamin (im Cytosol mit Hilfe von 5-Methyl-THF:Homocystein-Methyltransferase), 5'-Desoxy-adenosylcobalamin (in den Mitochondrien katalysiert von Vitamin-B12-Coenzym-Synthetase). C. wird über den Urin in intakter Form ausgeschieden (geringe Mengen < 0,25 µg / d).
Biochemische Funktionen: Methyl-Cobalamin und 5’-Desoxyadenosylcobalamin sind die zwei biologisch aktiven Formen des Vitamins B12 (Übertragung von aktiven Einkohlenstoffeinheiten) Als Coenzyme sind sie an den drei Cobalamin-abhängigen Stoffwechselreaktionen des Menschen beteiligt. Das sind die Umwandlungen von
Mangel: Cobalamin-Mangel.
Überdosierung: Diese ist ernährungsbedingt nicht möglich, auch bei 1000facher Überdosierung beobachtet man keine Nebenwirkungen.
Therapie: Einmalige hohe Dosen von Vitamin B12 alleine (1 mg) haben sich als effektiv erwiesen bei der Behandlung der perniziösen Anämie. Aus physiologischer Sicht scheint aber die regelmäßige Einnahme von Vitamin B12 in Kombination mit intrinsischem Faktor die günstigste Möglichkeit zu sein, die Vitamin-B12-Versorgung bei fehlendem IF sicherzustellen. Häufigste Therapieform bei fehlendem intrinsischem Faktor ist die parenterale Therapie, wobei 60–100 µg i. m. appliziert werden. C. wird auch verabreicht bei Homocysteinämie.
Statusbestimmung: Hierzu wird ein Belastungstest mit L-Valin durchgeführt, der eine Unterscheidung vom Folsäuremangel ermöglicht. Bestimmt wird die Konzentration an Methylmalonsäure im Urin. Beim Gesunden liegen die Werte bei 4–5 mg / 24 h, bei Cobalaminmangel-Patienten bei 60–90 mg / 24 h. Zur Serumkonzentrationsbestimmung werden mikrobielle Nachweisverfahren verwendet.
Cobalamin: Struktur der verschiedenen Vitamin-B12-Derivate. X = –CN (Cyanocobalamin), –OH (Hydroxo-Cobalamin), –NO2 (Nitrocobalamin). In den physiologisch aktiven Coenzym-Formen: X = CH3 (Methyl-Cobalamin) oder 5'-Desoxyadenosyl (5'-Desoxyadenosyl-Cobalamin). Cobalamin
Schreiben Sie uns!