Lexikon der Ernährung: Insulin
Insulin, E insulin, blutzuckersenkendes Hormon, das in den β-Zellen des endokrinen Teils (Langerhans-Inseln) der Bauchspeicheldrüse (Pankreas) gebildet wird.
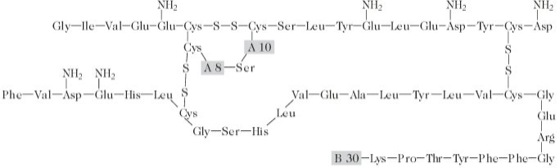
Struktur: I. ist ein aus zwei Peptidketten (A-Kette: 21 AS, B-Kette: 30 AS) aufgebautes Peptidhormon (Abb.). I. wird in Form des wesentlich größeren Vorläufers Prä-Pro-Insulin am rauen endoplasmatischen Reticulum gebildet. Beim Durchtritt durch die Membran in das Lumen des endoplasmatischen Reticulums wird die Signalsequenz entfernt und es entsteht das (kaum hormonell aktive) Pro-Insulin. Pro-Insulin wird zum Golgi-Apparat transportiert, wo die proteolytische Entfernung einer internen Sequenz, des Verbindungspeptids (E connecting peptide, C-Peptid, 31 AS) und zweier basischer Dipeptide beginnt. In den Speichergranula wird diese fortgesetzt. Das I. wird zusammen mit dem herausgeschnittenen C-Peptid durch Fusion der Membran reifer Speichergranula mit der Plasmamembran der Zelle freigesetzt, daher kann die Konzentration des C-Peptids zur Bestimmung der endogenen Insulinsynthese bei Patienten genutzt werden, denen Insulin supplementiert wird.
Geschichte: Der kanadische Arzt Frederick Grant Banting und Charles Best (Student) isolierten im Sommer 1921 erstmals Insulin und führten die ersten entscheidenden Untersuchungen an Hunden durch. Bereits am 11.1.1922 wurde Insulin mit Erfolg bei einem 14-jährigen Jungen eingesetzt.
Physiologische Wirkung: Insulin und sein Gegenspieler Glucagon sind die bedeutendsten Hormone der äußerst komplexen Regulation des Glucosestoffwechsels (Blutzuckerregulation). Die blutzuckersenkende Wirkung des Insulins beruht auf der Anregung des Transports der Glucose aus dem Blutstrom in die Körperzellen (Zellen des Muskel- und Fettgewebes, Leberzellen nehmen Glucose passiv durch Diffusion auf!) und in der Induktion des 1. Schlüsselenzymes der Glycolyse (während alle Schlüsselenzyme der Gluconeogenese durch I. gehemmt werden). Zur Vermittlung dieses Transports befinden sich in den Zellmembranen der Zielorgane Insulinrezeptoren. Zusätzlich hemmt I. Glucose freisetzende Mechanismen wie die Glucoseneubildung in der Leber (Gluconeogenese) und den Abbau von Glycogen (Glucosespeicher in Leber und Muskulatur). I. ist als anaboles Hormon daneben an zahlreichen Aufbaumechanismen des Organismus (z. B. Muskulatur, Fettgewebe) beteiligt. Es erhöht die Aufnahme von Aminosäuren v. a. in Muskelzellen, wodurch sich auch das Aminosäurespektrum des Extrazellulärraumes ändern kann (Fischer-Quotient). Ein I.-Mangel führt dazu, dass für die Energiegewinnung verstärkt Fettgewebe abgebaut wird. Die dadurch bedingte vermehrte Bildung von Ketonkörpern kann schwere Stoffwechselentgleisungen (Ketoacidose) auslösen. Stimuliert wird die I.-Sekretion durch Glucose selbst, die aus dem Abbau der mit der Nahrung zugeführten Kohlenhydrate entsteht Die Sekretion von I. wird ausgelöst, wenn die Blutglucosekonzentration über 5 mmol / l steigt, sowie durch andere Substrate, Hormone und Arzneimittel (Sulfonylharnstoffe, Repaglinide). Neben Leptin ist I. ein wichtiger Regulator der Nahrungsaufnahme (lipostatische Sättigungstheorie).
Insulinarten: Für die Behandlung des Diabetes mellitus stehen verschiedene I.-Arten zur Verfügung. Anfänglich gab es nur Rinderinsuline und Schweineinsuline, die aus den Inselzellen des Schlachtviehs gewonnen werden. In den 70er Jahren gelang es, über die Umwandlung von Schweineinsulin und auf gentechnologischem Wege (heterologe Genexpression) mit Hilfe von Escherichia coli reines Humaninsulin herzustellen, wodurch die Gefahr der Bildung von Antikörpern gegenüber nativem Schweine- und Rinderinsulin deutlich vermindert werden konnte (Abb.). Für die Neueinstellung eines Diabetes werden heute ausschließlich Humaninsuline verwendet. Nach der unterschiedlichen Wirkcharakteristik unterscheidet man zwischen kurz wirkendem Normalinsulin und lang wirkendem Verzögerungsinsulin. Weiterhin stehen Mischinsuline und Insulinanaloga zur Verfügung. Antidiabetika.
Insulin: Aminosäurensequenz von Human-, Schweine-, und Rinderinsulin (Mensch: A8 = Thr, A10 = Ile, B30 = Thr, Schwein: A8 = Thr, A10 = Ile, B30 = Ala, Rind: A8 = Ala, A10 = Val, B30 = Ala). Insulin
Schreiben Sie uns!