Lexikon der Geowissenschaften: elektrische Leitfähigkeit
elektrische Leitfähigkeit, 1) Allgemein: die Eigenschaft eines Körpers elektrische Ladungen zu transportieren. 2) Geophysik: gibt an wie viele Ladungen bei gegebener elektrischer Feldstärke durch eine Fläche transportiert werden. Die elektrische Leitfähigkeit σ kann über die elektrische Stromdichte I und die elektrische Feldstärke E definiert werden:
I = σE. (1)
Es ergibt sich als Einheit Siemens [S/m = A/(Vm) = 1/(Ohm m)]. Da es in der angelsächsischen Literatur z.T. unüblich ist, eine Firmenbezeichnung als Einheit zu verwenden, findet sich oft die reziproke Schreibweise für Ohm [mho]. Da die SI-Einheit [S = Siemens] nach dem Forscher Siemens benannt ist, setzt sich die SI-Schreibweise auch hier langsam durch. Für niedere Spannungen ist die elektrische Leitfähigkeit proportional zur Feldstärke und kann durch das Ohmsche Gesetz beschrieben werden (elektrischer Widerstand). Die elektrische Leitfähigkeit ist i.a. eine anisotrope Eigenschaft, die durch einen symmetrischen Tensor zweiter Stufe beschrieben werden kann (elektrische Anisotropie). Substanzen, die eine geringe elektrische Leitfähigkeit besitzen, werden als Isolatoren, sehr gute elektrische Leiter als elektrische Leiter bezeichnet. Viele Substanzen zeigen eine Leitfähigkeit dazwischen und werden als Halbleiter bezeichnet ( Tab. ). Oft hängt der Leitungstyp von Festkörpern an der elektronischen Bandstruktur (Valenzband, Bereich in dem sich die äußeren Elektronen normalerweise aufhalten; Leitungsband, Bereich in welchem Elektronen transportiert werden können). Sind Valenz- und Leitungsband weit auseinander, können nur sehr wenige Elektronen ins Leitungsband gelangen (Isolator). Liegen Valenz- und Leitungsband nah beieinander, wird eine höhere Leitfähigkeit beobachtet (Halbleiter). Überschneiden sich Valenz- und Leitungsband, werden sehr hohe Leitfähigkeiten beobachtet (elektrischer Leiter). Wird die elektrische Leitfähigkeit durch Elektronen im Leitungsband dominiert, wird dies als elektronische Leitfähigkeit bezeichnet (Metalle und viele Halbleiter, z.B. Silicium). Sind die Elektronen nicht mehr lokalisierbar (Elektronenwolke), wird von metallischer Leitfähigkeit gesprochen (Metalle, Graphit in Richtung der a-Achse). Wird die Leitfähigkeit von einem Ladungstransport im Valenzband bestimmt, wird formal ein Transport von Fehlstellen (Löchern) beschrieben (Löcherleitung, z.B. Halbleitersensoren). Dominieren Ionen den Ladungstransport ergibt sich die ionare Leitfähigkeit (z.B. Salzlösungen, Schmelzen, Lambda-Sonde). Sind mehrere Mechanismen am Ladungstransport beteiligt, wird von gemischter Leitfähigkeit gesprochen.
Die Temperaturabhängigkeit der elektrischen Leitfähigkeit von Mineralen wird durch den dominierenden Leitfähigkeitsmechanismus bestimmt. Die meisten Minerale sind elektronische Halbleiter. Die elektronische Leitfähigkeit σel von Halbleitern kann durch einen Arrhenius-Ansatz beschrieben werden:
wenn σ0el eine Konstante und EAel die entsprechende Aktivierungsenergie darstellt. Handelt es sich um einen Ionentransport, ergibt sich die elektrische Leitfähigkeit σion aus der Diffusion der Ladungsträger:
mit σ0ion einer Konstanten und EAion der Aktivierungsenergie für den Ionentransport (Ionendiffusion). In beiden Mechanismen führt eine Temperaturerhöhung zu einer Erhöhung der mobilen Ladungsträgerkonzentration. Die elektrische Leitfähigkeit von Schmelzen und Fluiden können mit Gleichung (3) beschrieben werden. Bei flüssigen Phasen, die im chemischen Gleichgewicht mit den festen Phasen stehen, muß im besonderen Maße die temperatur- und druckabhängige Änderung der chemischen Zusammensetzung berücksichtigt werden. Die Aktivierungsenergie liegt für die meisten Minerale und Schmelzen bei ca. 1 eV. In Metallen führt eine Erhöhung der Temperatur zu vermehrten Elektron-Elektron-Wechselwirkungen und damit zu einer Abnahme der elektrischen Leitfähigkeit σMetall:
σMetall = σ0Metall/T (4)
mit der Proportionalitätskonstante σ0Metall. Wechselwirkungen mit Gitterschwingungen führen zu einer zusätzlichen Reduzierung der elektronischen Leitfähigkeit. Die Druckabhängigkeit der elektrischen Leitfähigkeit ist i.a. wesentlich geringer als die Temperaturabhängigkeit. Der Einfluß des Druckes auf die Lage der Energieniveaus und damit auf die elektronische Leitfähigkeit ist relativ gering. Bei ionischem Ladungstransport können durch den Druck die Ionen i.a. schwerer durch das Gitter oder durch die flüssige Phase wandern. Dies führt dann zu einer Erhöhung der Aktivierungsenergie mit dem Druck. Die Temperatur- und Druckabhängigkeit der elektrischen Leitfähigkeit hängt entscheidend von den Mechanismen des Ladungstransports ab.
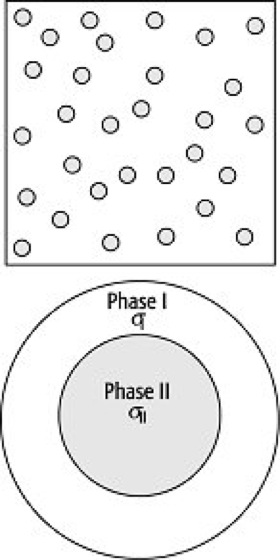
Für die Modellierung der elektrischen Leitfähigkeit von Phasengemischen (Petrophysik) sind – abhängig vom Gefüge – verschiedene Modelle bekannt. Das älteste isotrope Modell, unter der Annahme von Kugeln in einer homogenen Matrix, wurde von Maxwell (1881) beschrieben. Wagner und in jüngerer Zeit Hashin und Shtrikman sowie Waff erweiterten das Modell für komplexe Leitfähigkeiten ( Abb. 1 ).
Die elektrische Leitfähigkeit σ für ein binäres System von sphärischen Einschlüssen (Phase II) in einer homogenen Matrix (Phase I) ergibt sich mit den elektrischen Leitfähigkeiten σI und σII nach Maxwell-Wagner (abgeleitet entsprechend der "Theorie des effektiven Mediums") zu:
wenn XII den Volumenanteil der Phase II darstellt und der Einfluß von Korngrenzen vernachlässigt werden kann. Leitet die Matrix den Strom besser als die eingeschlossene Phase ergibt sich in der Summe eine hohe elektrische Leitfähigkeit (obere Grenze nach Hashin-Shtrikman). Wird die gut leitende Phase von einem Isolator umgeben, ist bei gleichen Volumina die Leitfähigkeit des Komposits wesentlich geringer als im ersten Fall (untere Grenze nach Hashin-Shtrikman). Die elektrische Leitfähigkeit wird demnach nicht nur von der Orientierung und den Volumenanteilen der einzelnen Phasen bestimmt, sondern in einem entscheidenden Maß auch von der räumlichen Anordnung der Phasen. Entscheidend für die elektrische Leitfähigkeit ist die Vernetzung der gut leitenden Phase.
In einem zweiphasigen Mineralgemisch soll die Phase I eine hohe elektrische Leitfähigkeit σ besitzen, während die zweite Phase einen Isolator darstellt. Je nach der Anordnung der Phasen fließt der elektrische Strom j in unterschiedlicher Art und Weise. Die Ladungsträger müssen hierbei unterschiedlich weite Wege zurücklegen ( Abb. 2 ). Die räumliche Verteilung der Mineralphasen und ihre Orientierung sind für die beobachtete Leitfähigkeit von großer Bedeutung. Der Stromfluß orientiert sich entlang von Pfaden mit hoher elektrischer Leitfähigkeit. Stromfluß und Elektrisches Feld müssen nicht parallel sein! An den Phasengrenzen können sich Kontaktpotentiale bilden, die sich dem äußeren E-Feld überlagern. Sind unterschiedliche Ladungsträger für die Leitfähigkeit der verschiedenen Phasen verantwortlich (z.B. Elektronen, Elektronenlöcher), kann es an den Phasengrenzen zu Sperrschichten kommen (z.B. p-n-Übergang), da die Ladungsträger nicht von einem Mineral in das andere gelangen können. Beide Effekte können die elektrische Leitfähigkeit von Phasengemischen erheblich beeinflussen. In heterogenen Proben kommt es an Korngrenzen und Poren bzw. Rissen zu Inhomogenitäten des elektrischen Feldes. So werden z.B. an Ecken, Kanten und Spitzen Extremwerte im elektrischen Feld beobachtet. Dies kann zu nichtlinearen Änderungen der elektrischen Leitfähigkeit (nicht-ohmsches Verhalten) in Bereichen anomaler E-Felder führen. Die elektrische Leitfähigkeit von Sedimenten hängt v.a. vom Salzgehalt der Porenflüssigkeit, Geometrie und Verteilung der Poren und Risse und damit von der Permeabilität ab (Petrophysik).
Durch die unterschiedlichen dielektrischen Suszeptibilitäten von Fluiden und Matrix kommt es bei fluid gefüllten Poren zur Ausbildung einer dielektrischen Doppelschicht. Diese, auch elektrische Doppel- oder Sternschicht genannte Schicht (Grenzflächenleitfähigkeit Abb. ) ist durch die starken elektrostatischen Anziehungskräfte relativ stabil und wird durch einen Strom- oder Fluidfluß nur unwesentlich beeinflußt. Dies führt zu einer Reduzierung der für den Transport zur Verfügung stehenden Querschnitte. Dadurch wird die elektrische Leitfähigkeit der Probe beeinflußt und die Permeabilität reduziert. Die verringerte Permeabilität führt zudem zu einem geringeren advektiven Wärmetransport bei einem Wärmetransport über die fluide Phase. Die elektrische Doppelschicht hat eine Dicke im Bereich einiger Atomlagen und beeinflußt deshalb v.a. kleine Röhren und Kanäle in der Probe, während der Einfluß bei großen Röhrendurchmessern vernachlässigt werden kann.
3) Hydrologie: elektrolytische Leitfähigkeit, Eigenschaft einer Wasserprobe, welche auf die in ihr enthaltenen Salze zurückgeht oder durch die bei der Dissoziation des Wassers (Leiter 2. Ordnung) gebildeten Ionen bedingt ist. Die elektrische Leitfähigkeit hängt von der Art und Konzentration der Ionen, sowie von der Temperatur und der Viskosität der Lösung ab. Sie wird als physikalische Kenngröße häufig herangezogen zur summarischen Erfassung von gelösten Ionen in Gewässerproben und Prozeßwasser (gemessen in Siemens/Meter).
4) Klimatologie: Eigenschaft eines Mediums, elektrischen Ladungsträgern die Bewegung unter dem Einfluß eines Feldes zu ermöglichen. Bei einer Leitfähigkeit σ gilt für die sich im Feld
![]()
einstellende Stromdichte
![]()
= σ·
![]()
. Die Leitfähigkeit der Atmosphäre wird durch die Konzentration und die Mobilität der negativen und positiven Luftionen bestimmt. Am niedrigsten ist sie in Bodennähe (3·10-14 Ω-1·m-1) und steigt mit zunehmender Höhe bis auf Werte über 10-5 Ω-1·m-1 in der Ionosphäre an. In der Ionosphäre wird die Leitfähigkeit anisotrop infolge des Einflusses des Erdmagnetfeldes auf die Bewegung der Ladungsträger. Durch die Anlagerung der Luftionen an Aerosole und Wolkentröpfchen wird die Leitfähigkeit erheblich reduziert.
elektrische Leitfähigkeit 1: geometrische Anordnungen binärer Mischungen, für die analytische Lösungen der elektrischen Kompositeigenschaften bekannt sind, wenn der Einfluß von Korngrenzen (z.B. p-n-Übergang, elektrische Doppelschicht) vernachlässigt wird. Die elektrische Leitfähigkeit σ für ein binäres System von sphärischen Einschlüssen (Phase II) in einer homogenen Matrix (Phase I) ergibt sich mit den elektrischen Leitfähigkeiten σI und σII. elektrische Leitfähigkeit 1:
elektrische Leitfähigkeit 2: In diesem zweiphasigen Mineralgemisch besitzt die Phase I eine hohe elektronische Leitfähigkeit σI, während die zweite Phase einen Isolator mit geringer Leitfähigkeit σII darstellt. Die elektrische Leitfähigkeit soll für beide Phasen richtungsunabhängig sein. a) Sind die Phasen parallel zum vorgegeben E-Feld (E = elektrische Feldstärke) orientiert, ist der Stromfluß in der Probe parallel zum beobachteten Stromfluß außerhalb der Probe. b) Sind die Phasen senkrecht zum vorgegeben E-Feld orientiert, ist der Stromfluß in der Probe ebenfalls parallel zum makroskopisch beobachteten Stromfluß. c) Liegen die Schichtpakete schräg zum angelegten E-Feld, resultiert ein Stromfluß schräg zum E-Feld. Mikroskopischer und makroskopisch beobachteter Stromfluß verlaufen parallel. d) Wird der Isolator von einer gut leitenden Matrix umgeben, werden im mikroskopischen Bereich die Feldlinien und der Stromfluß von der Anordnung der Phasen beeinflußt. Der Strom fließt auf gekrümmten Bahnen um den Isolator herum. e) Werden die gutleitenden Phasen vom Isolator eingeschlossen, ergibt sich in der Summe eine geringere Leitfähigkeit als im Fall d). Das elektrische Feld in der Probe ist gestört und die Ladungsträger bewegen sich bevorzugt durch die guten Leiter. elektrische Leitfähigkeit 2:

elektrische Leitfähigkeit (Tab.): Leitfähigkeiten einiger Stoffe. elektrische Leitfähigkeit (Tab.):

Schreiben Sie uns!