Lexikon der Neurowissenschaft: Fehlbildungen des Nervensystems
Essay
Peter Martin
Fehlbildungen des Nervensystems
Fehlbildungen des Nervensystems kommen deutlich häufiger vor als die anderer Organe. Sie werden in 2-3% aller Lebendgeburten und in 0,1-0,9% der Totgeburten und Sterbefälle während des 1. Lebensjahres festgestellt. Aufgrund der unbemerkt bleibenden Fälle liegt die Gesamthäufigkeit der Mißbildungen des Zentralnervensystems (ZNS) sehr wahrscheinlich erheblich höher. Fehlbildungen sind von sekundären Defekten des Nervensystems bei zuvor regelrecht vollzogener Organentwicklung (z.B. prä- oder perinatal entstandene Infarkte oder Blutungen) zu unterscheiden, wobei Kinder mit Entwicklungsstörungen auch häufiger von Schädigungen durch Sauerstoffmangel prä- oder perinatal betroffen sind. Solche Läsionen dürften andererseits die weitere, bei der Geburt keinesfalls abgeschlossene feinstrukturelle Differenzierung des Gehirns beeinflussen. Klinisch führen die Fehlbildungen des Nervensystems am häufigsten zu geistigen Retardierungen, Bewegungsstörungen und Epilepsien. Bei Entwicklungsstörungen des Kleinhirns und des Hirnstamms kommt es vor allem zu Ataxien und Störungen der Hirnnerven, und bei solchen des Rückenmarks vornehmlich zu Beinlähmungen, Blasen- und Mastdarmentleerungsstörungen und Störungen der sexuellen Funktionen.
Ursachen von Fehlbildungen
Die Art der Fehlbildungen und ihre Einteilung erklärt sich aus dem normalen Verlauf der Entwicklung und Differenzierung des Nervensystems ( siehe Zusatzinfo 1 ). Es können zahlreiche Ursachen zugrunde liegen, einerseits Chromosomenaberrationen bzw. -anomalien und sonstige Gendefekte, andererseits exogene Faktoren, darunter physikalische (z.B. ionisierende Strahlen) und chemische Noxen (z.B. Alkohol oder Medikamente, Teratogene), Infektionen (z.B. Röteln, Cytomegalievirus), Sauerstoffmangel und metabolische Störungen (z.B. Vitaminmangel oder Stoffwechselerkrankungen der Mutter). Multifaktorielle Verursachungen sind häufig anzunehmen, wobei vermutlich nicht selten exogene Schädigungen als Realisationsfaktoren bei genetischer Veranlagung wirken. Weniger die Art der Noxe als vielmehr der Zeitpunkt und die Zeitdauer ihres Einwirkens während der Entwicklung des Nervensystems sind entscheidend dafür, welche Fehlbildung entsteht und wie stark ihre Ausprägung ist (teratogenetische Determinationsperiode). Kombinationen von mehreren Fehlbildungen des ZNS und auch ein gleichzeitiges Auftreten mit Anomalien anderer Organsysteme kommen nicht selten vor.
Neurulationsstörungen/Dysrhaphien
Störungen der Neurulation in der 3. und 4. Gestationswoche führen zu dysrhaphischen Fehlbildungen (Störungen der Schließung des Neuralrohrs). Sie bilden die größte Gruppe der Mißbildung des Nervensystems. Schließstörungen des vorderen Neuralrohres bedingen Spaltbildungen des Schädels, der Hirnhäute und des Großhirns. Sie gehören zu den schwersten Fehlbildungen. Die ausgeprägteste Form bildet die Craniorhachischisis (totalis), bei der das Gehirn und das Rückenmark offen der Amnionflüssigkeit ausgesetzt sind; anstelle des neuronalen Gewebes findet man Bindegewebs- und Gefäßformationen. Bei der Anencephalie (Merocephalie, wenn größere Gehirnteile noch vorhanden sind), fehlt die Schädelkalotte; das Großhirn ist mehr oder weniger vollständig aplastisch; ein desorganisierter Hirnstamm und gelegentlich auch das Kleinhirn sind noch vorhanden. Der Schädelbasis liegt ein Netz von stark vaskularisiertem Bindegewebe mit eingelagerten glioneuronalen Gewebsanteilen auf (Area cerebrovasculosa). Spaltmißbildungen der Wirbelsäule bzw. des Rückenmarks können mit dieser Störung kombiniert sein. Kurzer Hals und hervortretende Augen (Exophthalmus) führen zu einem krötenkopfartigen Aussehen. Die Kinder überleben selten mehrere Monate; meist werden sie tot geboren oder sterben wenige Tage nach der Geburt. Bei der selteneren Iniencephalie liegt eine Sonderform vor, bei der sich der Defekt des Schädeldaches auf den Hinterhauptsknochen beschränkt, bei gleichzeitiger cervicaler Rachischisis.
Umschriebene craniale Verschlußstörungen zeigen sich in unterschiedlicher Ausprägung vom Cranium bifidum ocultum (median gelegene Knochenlücke) bis zur Exencephalie. Ein in der Mittellinie gelegener, in der Regel außen von Haut überdeckter Bruchsack kann entweder nur Hirnhäute und Cerebrospinalflüssigkeit(craniale Meningocele) oder zusätzlich Teile des Gehirns (Meningoencephalocele) und auch des Ventrikelsystems (Encephalocystocele, Exencephalie) enthalten. Diese Celen können occipital, frontal bzw. frontobasal und parietal lokalisiert sein. In westlichen Ländern findet man sie am häufigsten im Bereich des Hinterhaupts, in Asien häufiger frontal. Nicht selten sind craniale Celen mit anderen Gehirnfehlbildungen und auch mit sekundären Hirnschäden, insbesondere mit Hydrocephalus ( siehe Zusatzinfo 2 ), kombiniert. Beim Meckel-Syndrom findet man occipitale Encephalocelen in Verbindung mit Mißbildungen anderer Organsysteme (Augen, Herz, Nieren, Genitalien, Polydaktylie, Gaumenspalte).
Störungen der Neurulation werden jedoch häufiger im Bereich der Wirbelsäule und des Rückenmarkes beobachtet als am vorderen Ende des Neuralrohres. Bei der Spina bifida occulta handelt es sich embryologisch um eine Störung der Ablösung des Neuralrohrs vom Ektoderm in der 4. bis 5. Gestationswoche. Es kommt zu einer Spaltbildung der Wirbelbögen, meist im Bereich der Lendenwirbelsäule und ihres Übergangs zum Kreuzbein. Die Hautbedeckung ist intakt. Häufig bleibt die Spina bifida occulta symptomlos. Zur klinischen Manifestation kann es vor allem kommen, wenn durch eine Fixation (über Bindegewebssepten, ein aufgetriebenes Filum terminale oder Fettgewebe bzw. ein Lipom) des Conus medullaris oder der Cauda equina während des Wachstums betroffener Kinder und Jugendlicher (Ascensus des Rückenmarks) eine Zugwirkung auf diese Strukturen (tethered spinal cord syndrome) ausgeübt wird. Es können auch Kombinationen mit einer Diastematomyelie, einer Diplomyelie oder mit Mißbildungstumoren (Dermoide, Teratome) vorkommen. Beim tethered spinal cord syndrome treten Beinparesen, Blasen-Mastdarmstörungen oder neurotrophische Hautveränderungen auf. Fußdeformitäten (Klauen-Hohlfuß) sind bei der Spina bifida occulta nicht selten. Oft zeigt sich diese dysrhaphische Fehlbildung von außen durch Hautveränderungen (abnorme Behaarung, Angiome, Über- oder Unterpigmentierung der Haut) an.
Bei der Spina bifida cystica liegt eine Neurulationsstörung in der 4. Gestationswoche vor. Man unterscheidet hier die häufigeren offenen von den geschlossenenMyelomeningocelen. Bei der offenen Form findet man im Zentrum das frei an der Rückenoberfläche liegende, mißgebildete und stark gefäßversorgte Rückenmark (Zona medullo-vasculosa), in die der Zentralkanal mündet (Liquorfistel). Die betroffenen Kinder sind durch aufsteigende Infektionen und durch den meist zusätzlich vorkommenden Hydrocephalus (Aquäduktstenose oder gleichzeitig Chiari-Fehlbildung) gefährdet. Sie zeigen Lähmungen und Sensibilitätsstörungen (Querschnitt) sowie Blasen-Mastdarmstörungen. Bei der geschlossenen Myelomeningocele sind der Rückenmark- und Wirbelkanaldefekt überhäutet. Bei der Meningocele befinden sich in einer vorgewölbten und mit Haut bedeckten Cyste im Bereich der spinalen Spaltbildung nur Hirnhäute oder Wurzelfasern.
In die Gruppe der Spaltmißbildungen der dorsalen Mittellinie bzw. Fehlbildungen durch Ablösestörungen des Neuralrohrs werden auch Dermalsinus und Dermalfisteln (zusammengefaßt als Pilonidalsinus bezeichnet) sowie Dermalcysten (Dermoid-, Epidermoidcysten) eingeordnet. Sie kommen nicht selten zusammen mit einer Spina bifida occulta oder Diastematomyelie oder intraspinalen Tumoren (Teratome, Lipome) vor. Man beobachtet sie in der Regel in unteren oder oberen Wirbelsäulenabschnitten. Bei den Dermalfisteln führt ein mit Epithel ausgekleideter Kanal von der Hautoberfläche zum Spinalkanal und endet entweder außerhalb oder innerhalb des Duralsackes. Daraus erklärt sich die schwerste Komplikation, eine Meningitis.
Bei der Hydromyelie, die begrifflich nicht immer scharf gegenüber der (häufigeren) Syringomyelie abgegrenzt und auch dieser gleichgesetzt wird, handelt es sich um eine Fehlbildung, die den Dysrhaphien zugeordnet wird. Es findet sich eine glatt begrenzte, mit Ependym ausgekleidete symmetrische Aufweitung, in der Regel des Halsmarkes, die zum Teil mit dem IV. Ventrikel in Verbindung steht. Hydromyelien können mit anderen dysrhaphischen Störungen kombiniert sein. Häufig tritt ein Hydrocephalus auf. Die Ursache für das Offenbleiben und die Erweiterung des Zentralkanals bei dieser Fehlbildung ist nicht geklärt. Klinisch finden sich spastische Querschnittslähmungen, schlaffe Lähmungen in Höhe der Fehlbildung und dissoziierte Sensibilitätsstörungen sowie vegetative Symptome. Dieses Störungsbild entspricht der Klinik der Syringomyelie. Diese tritt häufiger primär, im Sinne einer Fehlbildung, aber auch sekundär bei späteren Schädigungen auf. Es kommt zu einer Höhlenbildung in der grauen Substanz des Rückenmarks, die sich einerseits bis weit in den Hirnstamm (Syringobulbie) und andererseits in untere Rückenmarksabschnitte ausdehnen kann. Sie führt zu einer Auftreibung des Rückenmarks in den betroffenen Abschnitten. Die Höhlen sind allenfalls nur teilweise mit Ependym ausgekleidet. In der Umgebung der Höhle findet sich histologisch eine charakteristische Gliavermehrung, die sich auch über den Rückenmarksdefekt hinaus erstrecken kann (Stiftgliose).
Die Spina bifida anterior ist wesentlich seltener als die hintere Spaltbildung. Ihr liegt eine Differenzierungsstörung der Chorda dorsalis zugrunde. Der Schädigungszeitpunkt muß vor dem der eigentlichen Dysrhaphien angenommen werden. Meist thorakal oder lumbosacral kommt es zu ventralen oder lateralen Duraausstülpungen durch fehlgebildete Wirbelkörper, von denen eine lokale Druckwirkung auf benachbarte innere Organe ausgehen kann. Zusätzliche Organfehlbildungen werden beobachtet.
Bei der Diastematomyelie und Diplomyelie (zusammengefaßt als split notochord syndrome) handelt es sich um kombinierte Fehlbildungen, fast immer im unteren Brustwirbelsäulen- und im Lendenwirbelsäulenbereich, die auf eine Entwicklungsstörung sowohl der Chorda dorsalis wie auch des Neuralrohres beruhen (3. Gestationswoche). Die Diastematomyelie besteht in einer Teilung des Rückenmarks in der Sagittalachse, getrennt durch ein knöchernes oder (seltener) bindegewebiges Septum. Beide Hälften des Rückenmarks sind von einer eigenen Dura mater und Arachnoidea umgeben. Bei einer Diplomyelie liegt eine Rückenmarksverdoppelung vor. In der Höhe dieser Fehlbildungen finden sich oft äußerlich Hautveränderungen. Typisch ist eine Wirbelsäulenverbiegung (Skoliose). Im Röntgenbild sind eine Spina bifida occulta und Wirbelkörperanomalien nachweisbar. Neurologische Störungen treten meist als Beinparesen oder Blasen-Mastdarmstörungen auf; z.T. auch im Zusammenhang mit einer Dehnungsschädigung während des Wachstums (entsprechend tethered spinal cord syndrome).
Mittelliniendefekte
Störungen in der frühen Entwicklung des rostralen Endhirns und der Kommissuren führen zu Defekten der Mittellinienstrukturen und schließen sich zeitlich an die Neurulationsstörungen an (5. bis 10. Gestationswoche). Die seltenen Holoprosencephalien (Zyklopie, Arhinencephalie) beruhen auf einer fehlenden oder unvollständigen Hemisphärentrennung mit Kommissurenmangel. Eine Riechlappenagenesie kann, muß jedoch nicht vorliegen. Nach der Schwere ihrer Ausprägung werden alobäre,semilobäre und lobäre Formen der Holoprosencephalie unterschieden. Hirnstamm und Kleinhirn sind regelrecht entwickelt. Oft kommt es gleichzeitig zu anderen Fehlbildungen (z.B. Heterotopien) und zu Kopf- und Gesichtsmißbildungen (Zyklopie, Lippen-Kiefer-Gaumenspalten, Hyper- oder Hypotelorismus). Die Aplasie des Bulbus olfactorius (eigentliche Arhinencephalie) kann isoliert, aber auch mit Verschmelzung von Thalamus und Mamillarkörpern und häufig mit leichten Gesichtsmißbildungen auftreten (Aplasie: fehlende Entwicklung einer Anlage). Bei einem Balkenmangel (Agenesie des Corpus callosum; Balkenagenesie) im engeren Sinne sind (im Gegensatz zur Holoprosencephalien) die Großhirnhemisphären getrennt. Er kann vollständig oder partiell sein (fast immer fehlen dann die hinteren Abschnitte). Bei dieser Fehlbildung verläuft am Dach der Seitenventrikel von vorne nach hinten ein variabel ausgebildetes Bündel von myelinisierten Nervenfasern, deren Bestimmung wahrscheinlich die Bildung des Balkens war (Probst-Längsbündel). Es gibt den Ventrikeln ein stierhornähnliches Aussehen. Ihr Occipitalhorn ist bei der Balkenagenesie erweitert. Sekundäre Hypoplasien des Balkens (durch Hemisphärenschädigungen) sind von der primären Mißbildungsform zu unterscheiden (Hypoplasie: unzureichende bzw. zu kleine Entwicklung einer Anlage). In der Mehrzahl der Fälle ist der Balkenmangel mit weiteren Mißbildungen des ZNS kombiniert, die dann auch mögliche klinische Symptome bestimmen. Abgesehen von Hypertelorismus sind Gesichtsfehlbildungen selten; häufiger kommen Mißbildungen anderer Organe vor. Beim Aicardi-Syndrom, das nur beim nur weiblichen Geschlecht auftritt, ist eine Agenesie des Corpus callosum mit einer Netzhautschädigung (Chorioretinopathie), Hemihypertrophie und Blitz-Nick-Salaam-Krämpfen kombiniert. Fehlbildungen des Septum pellucidum haben kaum klinische Bedeutung. Sehr selten wird ein vollständig fehlendes, nicht angelegtes Septum pellucidum gesehen. Hypoplasien des Septums finden sich in Kombination mit einem Balkenmangel. Die doppelseitige Verwachsung der Blätter des Septum pellucidum mit dem Caudatum bedingt eine sogenannte Pseudomonoventrikulie. Ein Spaltraum zwischen den Blättern des Septum pellucidum (Cavum septi pellucidi) ist häufig noch bei der Geburt vorhanden und verödet erst dann, kann aber in unterschiedlicher Ausprägung als Normvariante später nachweisbar sein. Dehnt sich dieser Spaltraum nach caudal weiter bis zum hinteren Abschnitt des Balkens aus, spricht man vom Cavum vergae, das (seltener) auch vom Cavum septi pellucidi getrennt sein kann. Echte Septum pellucidum-Cysten mit raumfordernder Wirkung, die auch zu Liquorabflußstörungen über das Foramen Monroi und zum Hydrocephalus führen können, sind selten. Als optico-septale Dysplasie werden ein Fehlen des Septum pellucidum, verbunden mit verschmächtigtem Opticus und endokrinen Störungen bezeichnet. Sie kommt möglicherweise nicht nur als primäre Entwicklungsstörung, sondern auch sekundär entstanden vor.
Störungen der Zellproliferation, -migration und -differenzierung
Die Proliferation neuroepithelialer Vorläuferzellen in der periventrikulären Matrix und die Differenzierung in Neuronen und Neuroglia sowie die Migration von Neuroblasten in fein abgestimmten aufeinanderfolgenden Schritten sind Voraussetzung für die regelrechte zelluläre und laminäre sowie kolumnäre Organisation des Cortex. Störungen und Noxen führen in diesem Entwicklungsabschnitt zu ausgedehnteren Substanzminderungen des Gehirns, Heterotopien und fehlerhaften Rinden- und Windungsbildungen.
Bei der schweren, selten beobachteten Fehlbildung des sogenannten Radial Microbrain liegt eine hochgradige Verminderung der Gehirngröße vor (Gehirngewicht 16 bis 50 g). Es finden sich eine normale Gyrierung und Schichtengliederung des Cortex bei erheblich reduziertem Neuronenbestand. Ursächlich wird eine verminderte Zellproliferation im periventriculären Keimlager (Matrix), bei darauffolgender normaler Migration angenommen. Betroffene Kinder können nur wenige Tage überleben. Die Microcephalia (Microencephalia) vera zeigt sich in einer Verminderung des Gehirnvolumens mit flachen Windungstälern (Sulci), verschmälertem Balken und histologisch reduzierter Neuronenzahl in den Rindenschichten 2 und 3. Ein zu frühes Proliferationsende in der Matrixzone (Erschöpfung des Keimlagers) wird als Ursache angenommen. Klinisch finden sich dabei Entwicklungsverzögerungen; es kommen genetische und sporadische Formen vor.
Viel häufiger gibt es Mikroencephalien anderer Ursache mit weitgehend normaler Gehirnarchitektur, wobei sich eine Vielzahl von ursächlichen Faktoren identifizieren lassen, auch Chromosomenanomalien (Chromosomopathien) mit Fehlbildungs-Retardierungssyndromen. Zu diesen gehört das Down-Syndrom (Trisomie 21), bei dem sich eine Mikroencephalie (in ca. 50% mit verschmälertem Gyrus temporalis superior) und eine Kleinhirnhypoplasie finden.
Mit den Begriffen Lissencephalie und Agyrie-Pachygyrie wird eine fehlende oder reduzierte Gyrifikation (wenige verbreiterte Windungen mit flachen Sulci; vermutlich aufgrund einer Migrationsstörung) bezeichnet. Bei der seltenen vollständigen Lissencephalie (Agyrie) fehlen die Windungen gänzlich. Meist kommen inkomplette Lissencephalien (Agyrie-Pachygyrie) vor. Es werden zwei Lissencephalietypen unterschieden ( siehe Zusatzinfo 3 ). Wenn nicht das gesamte Gehirn, sondern nur einzelne Gehirnabschnitte von Pachygyrien betroffen sind, spricht man auch von fokaler Makrogyrie.
Heterotopien sind Ansammlungen normaler Neurone in abnormer Lokalisation, in der Folge von Störungen der radialen Migration, die durch sehr unterschiedliche Faktoren bedingt sein können. Man unterscheidet subependymale (periventrikuläre) noduläre Heterotopien von fokalen (nodulären) subcorticalen ( siehe Abb. 1 ), bandförmig diffusen (laminären; siehe Abb. 2 ) und subpialen (leptomeningialen glioneuronalen) Heterotopien. Diese Fehlbildungen können isoliert oder in Kombination mit anderen Gehirnanomalien auftreten. Bandheterotopien kommen als X-chromosomal gebundene Fehlbildungen vor. In betroffenen Familien zeigen vorwiegend Frauen die Heterotopien, während bei Knaben Lissencephalien auftreten. Auch bilaterale periventrikuläre noduläre Heterotopien treten als X-chromosomale Fehlbildung auf. Heterotopien sind besonders häufig mit Epilepsien assoziiert, wobei epileptische Aktivität in den heterotopen Neuronen selbst nachgewiesen werden konnte.
Als Polymikrogyrien wird das Vorliegen von abnormen, in ihrer Anzahl vermehrten und in ihrer Größe verminderten, unvollständig bzw. nur durch flache Sulci voneinander getrennten Windungen bezeichnet ( siehe Abb. 3 ). Die Gehirnoberfläche weist im Bereich der Polymikrogyrien ein blumenkohlartiges Aussehen auf. Der Cortex ist abnorm verbreitert, jedoch nicht so dick wie bei Pachygyrien. Polymikrogyrien können eng umschrieben oder weit ausgedehnt vorkommen. Gehäuft findet man sie einseitig oder beidseitig in der Umgebung der Sylvius-Furche. Bei Polymikrogyrien konnten laminäre Nekrosezonen mit Schwerpunkt in der 5. Rindenschicht bei vorhandener Schichtengliederung des Cortex nachgewiesen werden. Eine Verursachung durch verminderte Durchblutung (Ischämie) nach der 20. Gestationswoche, d.h. eine postmigratorische Störung, wird für die meisten Fälle als ursächlich angenommen. Bei Polymikrogyrien mit fehlender Rindenschichtung ist eine frühere Schädigung zu postulieren. Durch perinatale Durchblutungsstörungen entstandene Schädigungen mit Verkleinerung der Windungen werden Ulegyrien genannt; sie sind von Polymikrogyrien zu unterscheiden und nicht den Fehlbildungen zuzuordnen (da perinatal). Bei der Schizencephalie wird der gleiche Entstehungsmechanismus wie bei den Polymikrogyrien angenommen. Es besteht eine mehr oder weniger breite liquorgefüllte Lücke, die vom Ventrikel bis zur Gehirnoberfläche reicht und bis in die Tiefe von einem Band grauer Substanz gesäumt ist. Übergänge von reinen Polymikrogyrien bis zur vollständigen Schizencephalie (Polymikrogyrien mit "infolding", "open-" und "closed-lip-"Schizencephalie) werden angenommen. In etwa einem Drittel der Fälle kommen Schizencephalien beidseitig vor. Die häufig auf ausgedehnte Infarkte oder Blutungen zurückgehenden Porencephalien sind später entstehende (encephaloklastische) Läsionen und weisen im Gegensatz zu Schizencephalien keine randständige graue Substanz auf.
Zu den Störungen der corticalen Gewebsdifferenzierung sind die fokalen corticalen Dysplasien zu rechnen (Dysplasie: fehlerhafte Entwicklung einer Anlage). Sie sind häufig und finden sich besonders im Zusammenhang mit fokalen Epilepsien. Fokale corticale Dysplasien bestehen in einer leichten Verdickung des Cortex und einer Störung der normalen Rindenschichtung und Organisation in variabler Ausprägung. Schwere Formen zeigen vergrößerte Neuronen, Astrogliavermehrung, große glioneuronale Zellen ("balloon cells"), subpiale glioneuronale Heterotopien und heterotope Zellen in der subcorticalen weißen Substanz. Es bestehen Ähnlichkeiten mit den Veränderungen bei tuberöser Hirnsklerose. Mit corticalen Fehlbildungen bzw. fokalen corticalen Dysplasien können Tumore (z.B. dysembryoplastische neuroepitheliale Tumore, Gangliogliome) assoziiert vorkommen.
Als Hamartien werden nicht-tumoröse Abnormitäten bezeichnet, die in der Phase der Differenzierung entstehen und eine irreguläre sowie fehlerhafte Durchmischung verschiedener Gewebskomponenten aufweisen. Als corticale und subcorticale glioneuronale Hamartien sind sie ebenfalls nicht selten Ursachen von Epilepsien. Bilden sie, wie bei der tuberösen Sklerose, größere tumoröse Läsionen, spricht man von glioneuronalen Hamartomen. Als isolierte tumoröse Gewebsmißbildung ist insbesondere das neuronale Hamartom des Hypothalamus (Tuber cinercum) gut definiert und klinisch vor allem durch das Auftreten von epileptischen Anfällen (initial Lachanfälle) und Verhaltensauffälligkeiten gekennzeichnet.
Bei der Hemimegalencephalie finden sich ebenfalls hamartomatöse Strukturen mit Neuronenvergrößerung und Astrogliavermehrung bzw. ausgedehnten Veränderungen wie bei tuberöser Sklerose, aber auch Heterotopien, Polymikrogyrien und Pachygyrien (sowie Blutungen, Ischämien und Verkalkungen). Die Pathogenese dieser Störung ist nicht bekannt. Die Determinationsphase wird im mittleren bis späten zweiten Schwangerschaftsdrittel vermutet. Das variabel ausgeprägte klinische Bild beinhaltet eine Entwicklungsretardierung, Hemiparese, Hemianopsie und Epilepsien sowie halbseitige Vergrößerungen von Kopf und Körper. Ein beidseitig abnorm großes Gehirn bezeichnet man als Megalencephalie (Gehirngewicht über 1600 Gramm). Sie kommt in der Mehrzahl der Fälle mit zusätzlichen makroskopischen oder mikroskopischen Anomalien vor; diese unterscheiden sich jedoch deutlich von denen, die bei der Hemimegalencephalie gefunden werden. Gewebsdifferenzierungsstörungen des Nervensystems mit multiplen hamartösen Fehlbildungen finden sich bei den neurocutanen Erkrankungen (Phakomatosen). Bei diesen treten gleichzeitig solche Veränderungen auch an den Augen, an der Haut und an weiteren Organsystemen auf. Zu ihnen zählen vor allem die Neurofibromatosen, die tuberöse Hirnsklerose und das Sturge-Weber-Syndrom.
Als Arachnoidalcysten bezeichnet man cystische Läsionen im Bereich des zentralen Nervensystems, die mit klarer Flüssigkeit gefüllt und innerhalb der Arachnoidea gelegen sind. Sie entstehen durch eine Fehlentwicklung des Arachnoidalgewebes, wobei es zu einer abnormen Aufteilung der Arachnoidalmembran in ein jeweils verdicktes äußeres und inneres Blatt kommt.
Störungen von Kleinhirn und Hirnstamm
Die Pathogenese der in der hinteren Schädelgrube (Kleinhirn, Hirnstamm) lokalisierten Fehlbildungen ist vielfach nicht geklärt; z.T. sind sie mit den dysrhaphischen Störungen assoziiert bzw. durch spaltförmige Defektbildungen gekennzeichnet. Unter den Kleinhirnmißbildungen wurden von Chiari vier Typen unterschieden, die mit angeborenem Hydrocephalus zusammen auftraten ( siehe Zusatzinfo 4 ). Das Dandy-Walker-Syndrom besteht in einem teilweisen (75%) oder vollständigen (25%) Fehlen des Kleinhirnwurmes. Der 4. Ventrikel ist zystisch aufgeweitet und besitzt (im Gegensatz zur Arachnoidalcyste) eine Ependymauskleidung. Die hintere Schädelgrube ist occipital stark erweitert, Tentoriumansatz und Sinus transversus stehen abnorm hoch. In 2/3 der Fälle werden zusätzlich ZNS-Mißbildungen (Balkenagenesie, Balkenlipom, Heterotopien, Syringomyelie) gefunden. Immer kommt ein Hydrocephalus vor, der sich gelegentlich auch noch spät im Erwachsenenalter manifestieren kann. Klinisch findet man neben Zeichen erhöhten Hirndrucks eine Vorwölbung des Hinterhaupts und cerebelläre Symptome sowie Hirnnervenstörungen. – Isolierte Hypoplasien und Aplasien des Kleinhirnwurmes(Rhombencephaloschisis) kommen vor. Beim seltenen autosomal rezessiven Joubert-Syndrom mit vollständiger oder partieller Vermisagenesie finden sich klinisch eine Ataxie, Augenbewegungsstörungen, Episoden vermehrter Atmung und geistige Retardierung mit Autismus. Bei der seltenen Rhombencephalosynapsis liegt eine Wurmagenesie ohne Spaltbildung bei hypoplastischem Kleinhirn vor. Eine völlige Agenesie des Kleinhirns ist sehr selten, einseitige Kleinhirnhemisphärenaplasien kommen jedoch vor. Auch im Kleinhirn werden, oft kombiniert mit anderen Kleinhirnfehlbildungen, Heterotopien beobachtet, ebenso fokale oder diffuse Dysplasien. Eine seltene Kleinhirnmißbildung ist das nach Lhermitte und Duclos benannte Syndrom (Lhermitte-Duclos-Krankheit) mit Hypertrophie des cerebellären Cortex (mehr oder weniger ausgedehnt). Dysplasien der Kleinhirnkerne können isoliert oder in Kombination mit weiteren Kleinhirn- oder Großhirnfehlbildungen auftreten.
Im Bereich des Hirnstammes kommen Aplasien von Hirnnervenkerngebieten vor, deren Entwicklung bis zur zweiten Schwangerschaftshälfte abgeschlossen ist. Sensorische Kerne sind in der Regel nicht betroffen. Meist handelt es sich um eine Aplasie der die Augenmuskeln versorgenden Nerven und des Facialis. Beim Möbius-Syndrom finden sich multiple angeborene Hirnnervenlähmungen mit ein- oder beidseitiger Facialislähmung, Oculomotoriuslähmung und Abducenslähmung, Zungenlähmungen oder motorischen Trigeminusausfällen. Klumpfuß, Arm- und Handfehlbildungen (Poland-Möbius-Anomalie) und mentale Retardierungen können assoziiert auftreten. Nicht in allen Fällen dieses Syndroms ist eine primäre Kernmalformation anzunehmen, es können auch sekundäre Schädigungen die Ursache sein. Zu den Anomalien des Hirnstamms gehören auch Dysplasien und Heterotopien der unteren Olivenkerne (Olive), die zum Teil in Verbindung mit cerebellären und Großhirnfehlbildungen zu finden sind. Ebenfalls oft in Kombination mit anderen Fehlbildungen werden Kreuzungsanomalien der corticospinalen Bahnen beobachtet.
Lit.:Friede, R.L.: Developmental Neuropathology 2nd Ed. Springer; Berlin, Heidelberg 1989. Neuhäuser, G.: Entwicklungsstörungen des Zentralnervensystems: Ursachen und Folgen. Kohlhammer; Stuttgart, Berlin, Köln, Mainz 1986. Volpe, J.J.: Neurology Of The Newborn 3rd Ed., Saunders 1995. Warkany J., Lemire R.J., Cohen M.M.: Mental Retardation And Congenital Malformations Of The Central Nervous System. Year Book Medical Publishers, Inc.; Chicago, London 1981. Aicardi J.: Diseases Of The Nervous System In Childhood. Cambridge University Press, 1998.
Fehlbildungen des Nervensystems
1 Entwicklung des Nervensystems:
In der Embryonalentwicklung bildet sich in der 2.-3. Woche nach der Befruchtung (Gestationswoche) aus dem äußersten der drei Keimblätter (Ektoderm) die Neuralplatte in der Mittellinie der Embryonalanlage. Die Chorda dorsalis (Notochorda), ventral der Neuralplatte gelegen, induziert deren Bildung aus dem Ektoderm und beeinflußt die Differenzierung des Neuralrohrs. Dieses löst sich in der 3. bis 4. Gestationswoche ab und wird unter die Oberfläche des Ektoderms in das Körperinnere verlagert. Das Neuralrohr, aus dem sich Gehirn und Rückenmark entwickeln, schließt sich in seiner vorderen Öffnung um den 25. Tag, in seiner hinteren etwa zwei Tage später. Die Entwicklung und der Schluß des Neuralrohres werden als Neurulation bezeichnet. Zellen, die am Rand der Neuralplatte gelegen sind, spalten sich zur Neuralleiste ab, aus der die Ganglien der hinteren Spinalnervenwurzeln und der Hirnnerven, vegetative Ganglien, Schwann-Zellen und die weichen Hirnhäute (Pia mater und Arachnoidea) gebildet werden. Der Neurulation schließt sich im vorderen Bereich des Neuralrohrs die Ausbildung der Hirnbläschen an. Im "Dreibläschenstadium" (3. bis 4. Gestationswoche) sind das spätere Vorderhirn (Prosencephalon) und die Vesikel für den späteren Hirnstamm (Mesencephalon und Rhombencephalon) abgrenzbar. Dann kommt es zu einer Aufteilung des Vorderhirnbläschens in Zwischen- und Endhirnvesikel (Telencephalon). Letzteres teilt sich wiederum nach beiden Seiten in die Hemisphärenbläschen (4. bis 5. Gestationswoche). Aus den telencephalen Vesikeln stülpt sich die Anlage des Riechkolbens (Bulbus olfactorius) um den 34. Tag. Vom Zwischenhirnbläschen gehen die Augenvesikel ab. Der Hirnstamm entwickelt sich zunächst rascher als das Endhirn. Aus dem Zwischenhirn entstehen Thalamus, Globus pallidus, Hypothalamus, Epiphyse und Neurohypophyse. Der basale Anteil des Telencephalons wird zum Ganglienhügel. Die Endhirnbläschen wachsen im weiteren Verlauf rasch um ihre Achse im Bereich der Insel; zum Ende des 4. Monats hin überlagern sie alle anderen Hirnteile. Ab der 14. Gestationswoche formen sich, beginnend mit der Fissura Sylvii, Furchen (Sulci; Sulcus) und Windungen (Gyri) aus. Die Gyrierung ist in der 32. Woche weitgehend, jedoch noch nicht vollständig abgeschlossen. In der vorderen Telencephalonwand bildet sich um den 40. Tag die Kommissurenplatte aus, aus der sich die Verbindungssysteme zwischen den Hemisphären entwickeln (Kommissur). Die größte Kommissurenbahn, der Balken (Corpus callosum) entwickelt sich von vorne (rostral) nach hinten (caudal) ab der 8. bis zum Ende der 20. Gestationswoche. Mit der Entwicklung des Balkens ist die des Septum pellucidum, das die Seitenventrikel in der Mittellinie voneinander trennt, eng verbunden; es entsteht ebenfalls aus der Kommissurenplatte. In der Umgebung der inneren Liquorräume (Cerebrospinalflüssigkeit) vermehren sich Vorläuferzellen für Nervenzellen und Gliazellen in der sogenannten subependymalen Matrix. Aus dieser wandern ab der 7. Gestationswoche die späteren Neurone der Großhirnrinde von der Ventrikelwand zur Gehirnoberfläche, entlang sogenannter radialer Gliafasern (Nervenzellwanderung). Wenn die äußerste Rindenschicht gebildet ist, erfolgt die weitere Schichtenbildung des Cortex von innen nach außen (Cajal-Retzius-Zelle). Teilung und Migration der Zellen im Telencephalon erfolgen zwischen der 6. und 24. Gestationswoche. Mit der Ausbildung von Nervenzellfortsätzen, Verbindungen zwischen Nervenzellen und der Markscheidenbildung (Myelinisierung) finden wesentliche Abschnitte des Gehirnwachstums und der Gehirnentwicklung auch noch weit nach der Geburt bis in die 2. Lebensdekade hinein statt.
Fehlbildungen des Nervensystems
2Hydrocephalien:
Die Ursachen einer Ventrikelaufweitung im Sinne eines Hydrocephalus sind zahlreich. Ein Verschlußhydrocephalus als (primäre) Fehlbildung kann durch eine Abflußbehinderung zwischen dem 3. und 4. Ventrikel (Aquäduktstenose) auch autosomal dominant oder geschlechtsgebunden rezessiv vorkommen. Sekundäre (z.B. entzündlich bedingte) Aquäduktstenosen müssen unterschieden werden. Hydrocephalien finden sich auch kombiniert mit Fehlbildungen wie Arnold-Chiari-Syndrom oder Dandy-Walker-Syndrom.
Fehlbildungen des Nervensystems
3Lissencephalietypen:
Beim Typ I findet sich eine Verbreiterung des (4-schichtigen) Cortex neben einer verminderten weißen Substanz, weiten hinteren Abschnitten der Seitenventrikel und eine Hypoplasie des Balkens sowie eine unvollständige Ausbildung des Hippocampus. Äußerlich zeigen die betroffenen Kinder eine Kopfeinbuchtung im Bereich der Schläfen bei vorspringendem Hinterhaupt und reduziertem Kopfumfang. Als ursächlich wird eine Störung der Migration in der 12. bis 16. Gestationswoche angenommen. Die Lissencephalie Typ I kann in schwerer Ausprägung und in Kombination mit weiteren Fehlbildungen und Auffälligkeiten (nach vorne gekehrte Nasenlöcher, Hornhauttrübung, Ohrmuschelabnormitäten, verkleinerter Unterkiefer, Vierfingerfurche, Poly- oder Syndaktylie, Herzfehler und verstärkte Behaarung) als Miller-Dieker-Syndrom vorkommen. Bei der Lissencephalie vom Typ II findet sich ebenfalls ein verdickter Cortex, jedoch ohne Schichtenbildung, häufig mit subcorticalen Heterotopien. Das Relief der Hirnoberfläche kann bei verschiedenen Individuen und in unterschiedlichen Regionen des Gehirns sehr variabel ausgebildet sein. Balkendysgenesien und Kleinhirnmißbildungen sowie ein Hydrocephalus (durch Verödung der Subarachnoidalraumes) kommen gelegentlich vor, ebenso ein- oder beidseitige Verkleinerungen des Auges. Insbesondere beim Walker-Warburg-Syndrom, bei dem teilweise eine angeborene Muskeldystrophie beobachtet wird, findet man zusätzlich eine occipitale Encephalocele.
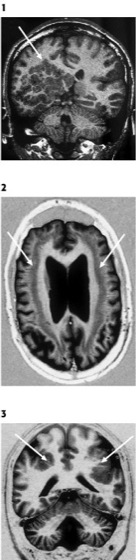
Fehlbildungen des Nervensystems
1 kernspintomographische Darstellung in coronaren T1-gewichteten Sequenzen, die ausgeprägte regionale subcorticale noduläre Heterotopien (Pfeil) zeigt.
2 kernspintomographische Darstellung in transversalen Inversion-Recovery-Sequenzen, die beidseitig subcorticale bandförmige Heterotopien (Pfeile) zeigt.
3 kernspintomographische Darstellung in coronaren Inversion-Recovery-Sequenzen, die beidseitig parietale Strukturauffälligkeiten der Rinde zeigt (Pfeile), welche am ehesten Polymikrogyrien entsprechen dürften.
Fehlbildungen des Nervensystems
4Chiari-Fehlbildungen:
Beim Chiari Typ I kommt es zu einer symmetrischen oder asymmetrischen Verlagerung der Kleinhirntonsillen in das Foramen magnum (Hinterhauptsloch) als Wachstumsanomalie. Diese Fehlbildung bleibt häufig ohne Symptome, kann aber auch zu Hirnnervenstörungen und Liquoraufstau führen. Der Typ II(Arnold-Chiari-Syndrom) zeigt eine Verlagerung von Teilen des Kleinhirnunterwurmes (Vermis inferior) in den cervicalen Spinalkanal in unterschiedlicher Ausprägung. Die Öffnungen des 4. Ventrikels liegen unterhalb des Foramen magnum, die Brücke ist langgezogen, und am Übergang des verlängerten Marks zum Halsmark findet sich eine Abknickung; das Kleinhirn ist hypoplastisch. In 90% treten Verschlußstörungen von Wirbelsäule und Rückenmark assoziiert auf, fast immer ein Hydrocephalus. Fehlbildungen des Großhirns können zusätzlich beobachtet werden. Klinisch zeigen sich neben Symptomen durch den Hydrocephalus und die Rückenmarksfehlbildung Hirnstamm- und Hirnnervenstörungen. Beim Typ III, der seltensten Form, wird eine Spaltbildung der Halswirbelsäule und des Hinterhauptbeines beobachtet mit Verlagerung des Kleinhirns in eine suboccipitale oder cervicale Cele. Der Typ IV (Hypoplasie des Kleinhirns) ist zur Klassifikation nicht geeignet.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.