Lexikon der Neurowissenschaft: GABA-Rezeptoren
GABA-Rezeptoren, γ-Aminobuttersäurerezeptoren, E GABA receptors, Transmembran-Glykoproteine, an die der inhibitorische Aminosäure-Neurotransmitter γ-Aminobuttersäure (GABA) bindet. Nach ihrer Empfindlichkeit gegenüber verschiedenenen Agonisten und Antagonisten sowie unterschiedlichen Postrezeptormechanismen lassen sich GABA-Rezeptoren in drei Subtypen unterteilen: den GABAA-, den GABAB- und den GABAC-Rezeptor. Alle drei Rezeptoren wirken hemmend. – Der GABAA-Rezeptor (Abk. GABAAR) ist ein ligandengesteuerter Chloridkanal (ligandengesteuerte Ionenkanäle). Aktivierung des GABAA-Rezeptors führt mit nur kurzer zeitlicher Verzögerung (Latenz < 5 ms) zum Öffnen der Kanalpore; GABAAR sind also Rezeptoren der schnellen synaptischen Informationsübertragung (Synapsen). Die Kanalpore ist für eine Reihe kleiner Anionen durchgängig (Cl-, SCN-, I-, Br-, NO3-). Von den physiologisch relevanten Anionen strömt, nach Öffnen der Kanäle, Cl- entlang seinem elektrochemischen Gradienten (die extrazellulären Cl--Konzentrationen sind etwa 30fach höher als die intrazellulären; Chloridkanäle) in das Zellinnere ein. Es resultiert eine Hyperpolarisation der Zelle; GABAAR sind also inhibitorisch und wirken neuronaler Erregung entgegen. Ein selektiver Antagonist an GABAA-Rezeptoren ist das Krampfgift Bicucullin. Das ebenfalls krampfauslösende Pikrotoxin wirkt ebenfalls antagonistisch an GABAAR. Es greift allerdings nicht an der GABA-Bindungsstelle an, sondern wirkt als Kanalblocker. Eine Reihe weiterer zentral wirksamer Pharmaka interferiert mit GABAAR, indem sie an spezifischen Bindungsstellen des Makromoleküls angreifen, die von der GABA-Erkennungsstelle verschieden sind. Dazu gehören Benzodiazepine wie z.B. Diazepam, Barbiturate, Steroide und Alkohol (Ethanol). Alle letztgenannten Substanzen verstärken die depressorische GABA-Wirkung ( siehe Abb. ). – Auch verschiedene Erkrankungen stehen im Zusammenhang mit dem GABAAR. So wurde z.B. vorgeschlagen, daß, neben anderen Ursachen, ein Defizit der GABAergen Neurotransmission Epilepsien verursachen könnte. Dafür sprechen einerseits die krampfhemmende Wirkung von Diazepam (GABA-Potenzierung) und andererseits die Anfall-auslösenden Effekte von Bicucullin. Auch die Tatsache, daß Valproat (Dipropylacetat; Valproinsäure), welches das GABA-abbauende Enzym GABA-Transaminase hemmt und so zur Akkumulation des Transmitters führen kann, antiepileptisch wirkt, deutet in diese Richtung ( siehe Zusatzinfo ). – Die GABAA-Rezeptor-Moleküle wurden zuerst mittels Benzodiazepin-Affinitätschromatographie aus Membranpräparationen des Säugergehirns gereinigt. Die Molekülmasse des Gesamtproteins beträgt ca. 220 kDa-400 kDa. Mittels molekularer Klonierungstechniken konnten vier unterschiedliche Untereinheiten (α, β, γ, δ) mit einer Molekülmasse von 50 kDa-60 kDa und multiple Gene für diese Polypeptide nachgewiesen werden. Sie zeigen untereinander 20-40% Homologie in der Aminosäuresequenz und 10-20% Identität mit Untereinheiten des nicotinischen Acetylcholinrezeptors. Man geht davon aus, daß das GABAAR-Gesamtmolekül ein Hetero-Oligomer aus fünf solcher Polypeptide ist. Alle Untereinheiten haben, ähnlich wie die des nicotinischen Acetylcholinrezeptors, vier mögliche membrandurchspannende Segmente (M1-M4), die aus einer Aminosäuresequenz von 22-23 α-helical angeordneten Resten bestehen. Expressionsversuche bei Frosch-Oocyten zeigten, daß alle Polypeptiduntereinheiten GABA-aktivierbare Cl--Kanäle bilden, die durch Pikrotoxin blockiert werden konnten und deren Leitfähigkeit durch Pentobarbital gesteigert wurde. Die Bindungsstelle für Benzodiazepine liegt auf der γ-Untereinheit. In unterschiedlichen Gehirnregionen ist der GABAAR aus unterschiedlichen Untereinheiten aufgebaut. Dementsprechend besitzen die einzelnen Gehirnregionen unterschiedliche Sensitivitäten für Benzodiazepine und andere am GABAAR bindende Substanzen. – Der GABAB-Rezeptor (Abk. GABABR) vermindert über ein G-Protein die Leitfähigkeit für Calciumkanäle. Er wird selektiv durch Baclofen (ein zentrales Muskelrelaxans) aktiviert. GABAB-Rezeptoren wirken an neuronalen Zellen inhibitorisch, indem sie entweder den (depolarisierenden) Ca2+-Einstrom durch Calciumkanäle hemmen oder den (hyperpolarisierenden) K+-Ausstrom durch Kaliumkanäle steigern. GABAB-Rezeptoren sind häufig präsynaptisch lokalisiert und können dort die Transmitterfreisetzung hemmen. Zwei GABAB-Rezeptor-Proteine wurden kloniert (GBR1 und GBR2 für GABAB-Rezeptor 1 und GABAB-Rezeptor 2). Beide Proteine müssen sich zu Heterodimeren zusammenlagern, um voll funktionsfähige Rezeptoren zu bilden. – Der GABAC-Rezeptor (Abk. GABACR) ist das bisher letzte entdeckte Mitglied der GABA-Rezeptoren-Familie. Er kommt vermutlich ausschließlich in der Netzhaut vor. Wie beim GABAAR handelt es sich um einen ligandengesteuerten Chloridkanal. Der GABACR wird nicht von Bicucullin geblockt und auch nicht von Barbituraten, Benzodiazepinen oder Steroiden moduliert. Hingegen wird er selektiv von cis-4-Aminocrotonsäure (CACA) aktiviert. Im Vergleich zum GABAAR wird der GABACR von geringeren Konzentrationen an GABA aktiviert, und der Kanal bleibt länger offen. Bislang sind zwei Untereinheiten des GABACR bekannt, r1 und r2. – Neuen Erkenntnissen zufolge können Dopaminrezeptoren des D5-Typs die Funktion der GABA-Rezeptoren abändern, indem sie mit diesen einen Rezeptor-Rezeptor-Komplex bilden, also direkt, ohne zwischengeschaltete G-Proteine, an sie binden.
W.N./S.Lz.
7 verschiedene GABA-Rezeptor-Kanal-Proteinuntereinheiten, einige mit zusätzlichen Isoformen, wurden bisher aus den Gehirnen von Säugern kloniert: α1-α6, β1-β3, γ1-γ3, δ, ε, π und ρ1-ρ3. Die Aminosäuresequenzen der Protein-Untereinheiten zeigen eine Sequenzidentität (20-30%) mit denen anderer ligandengesteuerter Ionenkanäle. Die Aminosäure-Identität zwischen den einzelnen Isoformen der Proteine aus einer Klasse beträgt ca. 70%, zwischen den Subklassen ca. 30%. Die GABAAR werden aus α-, β- und γ-Untereinheiten aufgebaut, die GABACR bestehen anscheinend ausschließlich aus den Isoformen der ρ-Untereinheiten. Die ρ-Untereinheiten für die GABACR werden neben der Netzhaut vor allem im Kleinhirn und im Hippocampus gefunden.
GABA-Rezeptoren
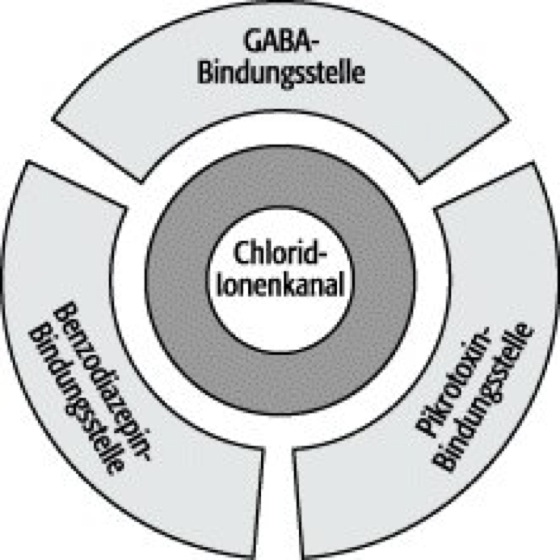
theoretisches Modell des GABAA-Rezeptorkomplexes:
Der Komplex enthält 3 Bindungsstellen: für GABA, Pikrotoxin und Benzodiazepine. Der Ionenkanal ist entweder eine separate Komponente oder Teil einer der 3 Bindungsstellen-tragenden Proteine. Nach diesem Modell wird die GABA-induzierte Öffnung des Ionenkanals durch Substanzen, die an die beiden anderen Bindungsstellen binden, moduliert.
GABA-Rezeptoren
Bei Personen mit Klaustrophobie ist die Anzahl der GABAAR in bestimmten Regionen des Gehirns vermindert. Um den Zusammenhang zwischen dieser Erkrankung und dem GABAAR weiter zu erforschen, wurden Mäuse gezüchtet, bei denen auf einem Chromosom eine γ-Untereinheit des GABA-Rezeptors inaktiviert worden war. Die Tiere waren hyperängstlich, sie scheuten fremdes Territorium und vermieden Höhen und helles Licht. Gab man ihnen jedoch geringe Mengen an Diazepam, so verschwanden die Symptome. Man vermutet nun, daß krankhafte Angstzustände (Angststörungen) unter anderem durch einen Mangel an GABA entstehen können.
Schreiben Sie uns!