Lexikon der Neurowissenschaft: Schmerz
Essay
Manfred Zimmermann
Schmerz
Definition und Funktion
"Der Schmerz ist ein unangenehmes Sinnes- oder Gefühlserlebnis, das mit aktuellen oder potentiellen Gewebeschädigungen verknüpft ist oder mit Begriffen solcher Schädigungen beschrieben wird" (Definition der International Association for the Study of Pain [IASP], 1979). Die v.a. im 19. u. 20. Jh. entstandene Unterscheidung von körperlichem und seelischem Schmerz wird durch die Schmerzforschung (Algesiologie) heute zunehmend abgebaut. Biologisch gesehen ist der Schmerz (E pain) ein Sinnessystem, das sowohl potentielle Schäden von außen (z.B. Hitzeschmerz vor Auftreten einer Verbrennung) als auch von innen (z.B. Bauchschmerz bei Blinddarmentzündung) signalisiert ( siehe Zusatzinfo 1 ). Er hat somit die Eigenschaft eines Schadensfrühwarnsystems ("der bellende Wachhund der Gesundheit"), wir sprechen auch vom nozizeptiven System oder der Nozizeption [von latein. nocere = schädigen, noxa = der Schaden]. Aktivierung des nozizeptiven Systems führt zu Schutzreaktionen (protektives System), die vom unbewußt ablaufenden Reflex (z.B. schnelles Wegziehen der Hand von einem heißen Gegenstand) bis zur zielgerichteten Handlung (z.B. Einnahme eines Schmerzmedikaments) reichen. Das Schmerzsystem ist wegen seiner Schutz- und Vermeidungsfunktion für Mensch und Tier lebenswichtig. Lebewesen mit einer defekten Schmerzwahrnehmung sind in ständiger Verletzungs- und Infektionsgefahr, die Lebenserwartung kann vermindert sein. So fehlt z.B. bei einem Teil der Patienten mit einer koronaren Herzkrankheit (Sauerstoffmangel des Herzmuskels) der Herzschmerz (Angina pectoris), bei ihnen kann selbst ein Herzinfarkt völlig schmerzfrei verlaufen (stiller Herzinfarkt), mit höherem Todesfallrisiko als bei einem schmerzhaften Infarkt.
Schmerz als Leiden
Dem nützlichen Aspekt des Schmerzes als Sinnessystem steht der Leidensaspekt v.a. eines längerdauernden Schmerzzustands für den Betroffenen gegenüber ("Schmerz als Geißel der Menschheit"). Die Grenzziehung zwischen diesen beiden Aspekten liegt vor allem in der zeitlichen Dimension. Bei der Warnfunktion ist der Schmerzzustand meistens von kurzer Dauer, er bewirkt selbst seine Beendigung, indem der Betroffene sich der äußeren Bedrohung entzieht oder die Heilung der Krankheit herbeiführt. Wenn aus diesem akuten Schmerz jedoch ein chronischer Schmerzzustand wird, erhält der Schmerz für den Betroffenen und seine Umgebung die Dimension des (sinnlosen) Leidens, die Lebensqualität ist erheblich eingeschränkt. Die Leidensverminderung durch Schmerztherapie ist eine wichtige Aufgabe der Medizin (s.u.).
Chronische Schmerzen mit erheblicher Beeinträchtigung des Lebensvollzugs treten in Industriegesellschaften bei mindestens 8% der Erwachsenen auf, in Deutschland sind dies ca. 5 Millionen Betroffene. Häufig sind: Rücken- und Kopfschmerzen, Schmerzen durch Schädigungen des Nervensystems (neuropathische Schmerzen; Polyneuropathie). Bei einem Teil der Schmerzbetroffenen kommt es zur fortschreitenden Schmerzchronifizierung (chronifizierender Schmerz), dabei kann sich der Schmerz von einer ursprünglich vorhandenen Ursache entfernen, wir sprechen dann von der Schmerzkrankheit. Bei der Chronifizierung wirken biologische, psychische und soziale Risikofaktoren (z.B. Schonhaltung, depressive Lebenssicht, Krankheitsgewinn) mit. Dabei ist die Bildung eines Engramms im Zentralnervensystem (ZNS) beteiligt, wir sprechen vom Schmerzgedächtnis, z.B. bei Phantomschmerz.
Zur Versorgung der Schmerzkranken werden heute multidisziplinäre Behandlungsansätze für notwendig angesehen. Rechtzeitige Schmerzbehandlung (Sekundärprävention) soll fortschreitende Chronifizierung verhüten. Aus juristischer Sicht hat der Patient ein Recht auf Schmerzbehandlung. Viele schmerztherapeutische Wirkungen werden v.a. durch hemmende Systeme im ZNS vermittelt (z.B. Analgetika, Nervenstimulation, Sport, Hypnotherapie, Streß). Zunehmend wird die Bedeutung der psychologischen Schmerztherapie erkannt, die z.B. Fragen der Sinngebung, Selbstheilungskräfte, Schmerzbewältigung, Verhaltensänderung und Eigenmotivation in das Behandlungskonzept einbringt. In Deutschland wurde 1996 die ärztliche Zusatzbezeichnung "Spezielle Schmerztherapie" eingeführt.
Schmerz in der Menschheitsgeschichte
Aufgrund seiner elementaren biologischen Wertigkeit kann man davon ausgehen, daß der Schmerz die Menschheitsentwicklung von Anfang an begleitet hat. Dabei war er sicherlich ein Element des Erkennens und Tuns bei den ersten Ansätzen einer Medizin, darüberhinaus hat der Schmerz wahrscheinlich auch bei der beginnenden bewußten Auseinandersetzung (Bewußtsein) des Menschen mit sich und seiner Umgebung, in der Kommunikation und beim Denken eine bedeutende Rolle gespielt.
Wie viele andere primär biologisch begründete Vorgänge und Erfahrungen wurde auch der Schmerz in die sich entwickelnden Denk- und Sozialsysteme eingeordnet und ritualisiert. So wurden wahrscheinlich in allen Sozialsystemen der Menschheitsgeschichte schmerzerzeugende Strafen zur Ahndung von lebens- und gemeinschaftsschädlichen Verhaltensweisen angewandt, wahrscheinlich lange vor dem Aufkommen des Freiheitsentzugs als Strafmaßnahme. Auch in der Kindererziehung wurden und werden schmerzhafte Maßnahmen zur Lenkung der Sozialentwicklung benutzt. Bei der Folter werden Schmerzreize an wehrlosen Opfern auch heute noch vor allem zur gewaltsamen Erhaltung von politischer Macht eingesetzt. Bei vielen Naturvölkern ist die Aufnahme in die Erwachsenenwelt mit schmerzhaften Initiationsriten verbunden, damit werden die Gesetze der Gesellschaft "eingebrannt".
In den Religionen und philosophischen Systemen nimmt der Schmerz einen wichtigen Platz ein. Am besten ist uns die Sinndeutung des Schmerzes in den christlichen Religionen geläufig: Schmerz (auch als Synonym für Leid), den der Gläubige auf Erden erdulden muß, gilt als eine Vorbedingung zur Erlangung der ewigen Glückseligkeit. Andererseits wird der Schmerz auch als gerechte Sühne oder Strafe für Sünden gedeutet.
Schmerz bei Tieren und Schmerzforschung
Auch Tiere haben ein nozizeptives System zum Schutz vor Gefahren. Bei Schadensreizen zeigen besonders Säugetiere Verhaltensreaktionen, die den Schmerzreaktionen des Menschen ähnlich sind. Auch bei Erkrankungen verhalten sich Tiere ähnlich wie menschliche Patienten, die Schmerzen haben. Schließlich lernen Tiere wie Menschen, wiederkehrende Situationen aktiv zu vermeiden, in denen sie früher mit unangenehmen und schmerzhaften Reizen konfrontiert worden waren ("Gebranntes Kind scheut das Feuer"). Die Neurophysiologie des nozizeptiven Systems zur Meldung von Schadensreizen ist bei den übrigen Säugetieren ähnlich wie beim Menschen ausgebildet; wegen dieser Ähnlichkeit von Neurophysiologie und Verhalten können wir davon ausgehen, daß zumindest Säugetiere (und wohl auch andere höhere Wirbeltiere) Schmerzen erleben und erleiden. In der Tradition des Umgangs mit dem Haustier wird seit langem die Leidensfähigkeit des Tieres durch Schmerz anerkannt. Andererseits gibt es althergebrachte und z.T. ritualisierte Schmerzzufügungen bei Sport und Spiel (Stier- und Hahnenkampf, Reitsport, Jagd). Bei den Tierschutzgesetzen steht das Verbot der Zufügung von Schmerzen im Vordergrund.
Ein großer Teil unseres Wissens über Schmerz und Schmerzbehandlung konnte in Tierexperimenten erforscht werden, überwiegend am narkotisierten Tier (Narkose). Zur Erforschung klinisch relevanter Schmerzen müssen jedoch auch bei wachen Tieren unter wissenschaftlich kontrollierten Bedingungen Schmerzreize zugefügt werden. Es ist ein Gebot der Ethik (Ethische Probleme in der Neurowissenschaft), das auch als Norm im Tierschutzgesetz ausgedrückt ist, Tierversuche so schonend wie möglich durchzuführen. Mit diesem Ziel haben Wissenschaftler, die auf dem Gebiet des Leidens bei Tieren besonders sachkundig sind, ethische Richtlinien für die tierexperimentelle Schmerzforschung ausgearbeitet.
Tierschonende Schmerzforschung läßt sich auf verschiedene Weise verwirklichen. So können viele körperliche und neuronale Teilvorgänge, die unterhalb der Bewußtseinsebene ablaufen, am Tier in Vollnarkose untersucht werden. Bei der Schmerzforschung an trainierten wachen Tieren können diese selbst die Schmerzreize in ihrer Intensität kontrollieren oder abschalten (operante Kontrolle), wie bei der Dressur können die Tiere dabei durch systematische Belohnungen zur Kooperation gewonnen werden. Bei der tierexperimentellen Erforschung von krankheitsbedingten Schmerzen und deren Behandlungsmöglichkeiten ist es oft unvermeidlich, daß die Tiere unter Schmerzen leiden. Das Experiment muß dann so geplant werden, daß der Schmerzzustand so gering und so kurz wie möglich gehalten wird, nach Möglichkeit sollen die Tiere mit schmerzdämpfenden Medikamenten behandelt werden. Bei solchen Projekten muß sorgfältig abgewogen werden, ob der wissenschaftliche Erkenntniswert und die erhoffte Verbesserung der Möglichkeiten, schmerzkranken Patienten zu helfen, das begrenzte Leiden bei Tieren rechtfertigen.
Nozizeptoren
Die nervösen Empfänger oder Rezeptoren für gefährliche Reize nennen wir Nozizeptoren oder Schmerzrezeptoren ( siehe Zusatzinfo 2 ). Die Nozizeptoren der Haut gewährleisten, daß Verletzungseinflüsse nicht unbemerkt in den Körper eindringen. Auch alle anderen Organe (Muskeln, Gelenke, innere Organe) sind mit Nozizeptoren bestückt, so daß Erkrankungen gemeldet werden. Leider versagt das Warnsystem bei einigen gefährlichen Erkrankungen meistens, z.B. bei Bluthochdruck und Krebs. Körpereigene Schmerzmediatoren ( siehe Zusatzinfo 3 ) machen die Nozizeptoren empfindlicher, sie sprechen dann auf Reize geringer Stärke an, die normalerweise nicht schädlich sind. Ein anschauliches Beispiel für die Sensibilisierung der Nozizeptoren bei einer Entzündung ist der Sonnenbrand: kleinste Reize können dann zu Erregungen der Nozizeptoren und dadurch zu Schmerzempfindungen führen. Die Aktivierung der Nozizeptoren durch Schmerzmediatoren wird durch bestimmte Schmerzmedikamente (Analgetika) gehemmt, z.B. die Acetylsalicylsäure. Diese Medikamente wirken also v.a. dort, wo die nervösen Schmerzinformationen entstehen, wir sprechen von peripheren analgetischen Mechanismen. Andere Schmerzmedikamente wirken im Zentralnervensystem, z.B. das Morphin. Viele Nichtopiate haben sowohl periphere als auch zentrale analgetische Mechanismen. Umgekehrt wurden auch im peripheren Nervensystem analgetische Wirkungen der Opiate entdeckt, besonders unter den Bedingungen einer Entzündung. Die klinische Bedeutung dieser Beobachtungen ist jedoch noch nicht klar.
Nozizeptorschmerzen sind Schmerzen, die über die Aktivität von Nozizeptoren ausgelöst werden. Im Gegensatz dazu stehen Nervenschmerzen (neuropathische Schmerzen oder Neuralgien), die durch Schäden am Nervensystem verursacht werden; das sind z.B. Schmerzen nach Amputation, bei einer Nervenkompression (Nervenkompressionssyndrom) oder bei einer Polyneuropathie, wie sie z.B. im Verlauf einer Zuckerkrankheit auftreten kann (diabetische Polyneuropathie), und die Post-Zoster-Neuralgie nach einer Gesichts- oder Gürtelrose. Diese Schmerzen lassen sich nicht durch die Erregung von Nozizeptoren erklären, sie beruhen vielmehr auf einer abnormalen Erregbarkeit sensorischer Nerven zwischen den Nozizeptoren und dem Gehirn. Die Nervenfasern, die normalerweise nur zur Weiterleitung von elektrischen Signalen dienen, werden nach solchen Vorschädigungen selbst durch kleinste mechanische Reize erregt, vor allem bei Bewegungen der umgebenden Muskeln oder Sehnen. Dadurch kommt es u.a. zu einschießenden schmerzhaften Reizwahrnehmungen. Auch das Stechen und Kribbeln bei einem "eingeschlafenen" Bein sind auf solche unnatürlichen Erregungen von Nervenfasern zurückzuführen. Bei einem geschädigten Nerv laufen diese abnormalen Erregungsprozesse ständig ab, der Patient hat Schmerzen und gestörte Empfindungen. Ein gesunder Nerv spricht in der Regel nicht derartig auf Berührungs- und Bewegungsreize an.
Schmerz durch Fehlregulation
Viele Vorgänge in unserem Körper werden über Hormone bzw. das Nervensystem ständig automatisch geregelt, z.B. die Durchblutung der Organe oder die Anspannung der Muskeln. Das Gehirn als Regulationszentrum wirkt ständig auf diese Vorgänge ein, so daß ein sinnvoller, d.h. den augenblicklichen Bedürfnissen entsprechender Zustand eingehalten wird. Manchmal versagt die Regulation jedoch, unsere Blutgefäße in den Gliedmaßen oder im Gehirn werden zu eng oder weit, die Muskeln, die unsere Körperstellung halten, werden übertrieben angespannt. Diese Fehlregulationen können zu Schmerzen führen, weil sie die Erregung der Nozizeptoren begünstigen. Manche Kopfschmerzen, z.B. die Migräne, beruhen auf einer Fehlregulation der Hirngefäße. Bei Nacken- oder Kreuzschmerzen sind häufig Fehlregulationen der Muskelspannung beteiligt. Bei solchen Schmerzen hilft oft der Versuch, die gestörte Regulation wieder zu normalisieren. So werden bei Migräne Medikamente oder psychologische Verfahren eingesetzt, mit dem Ziel, die Blutgefäßreaktionen im Schädel zu stabilisieren. Bei Schmerzen, die durch zu hohe Muskelspannungen bedingt sind, können vorübergehende Muskelentkrampfungen helfen, z.B. mit Lokalanästhetika oder Muskelrelaxantien. Durch Krankengymnastik können die abnormalen Steuerungsbefehle zu den Muskeln durch Umlernen wieder normalisiert werden, worauf die Besserung der Schmerzen zurückgeführt wird.
Vorgänge im Zentralnervensystem
Die über die Nerven hereinkommenden elektrischen Impulse werden im Rückenmark und Gehirn auf komplexe Weise verarbeitet ( siehe Abb. ). Das trifft für die Meldungen aus allen Sinnessystemen zu, auch für die nervösen Schmerzinformationen. Es gibt in unserem Gehirn jedoch kein eigentliches Schmerzzentrum, deshalb ist es nicht möglich, durch einen hirnchirurgischen Eingriff die Schmerzempfindlichkeit zu beseitigen. Nervöse Schmerznachrichten lösen Vorgänge in mehreren Hirnbereichen aus, die zu den vielfältigen und individuell unterschiedlichen Wahrnehmungen, Gefühlen und Reaktionen führen, deren Gesamtheit wir als Schmerzen erleben. Es kommt 1) zu weitgehend automatischen körperlichen Reaktionen, also motorischen Reflexen, Blutdruckanstieg, Ausschüttung von Streßhormonen; 2) zu bewußten Wahrnehmungen, die stark unseren Gefühlshaushalt verändern; 3) zu verstandesmäßigen Bewertungen und Reaktionen (wir nehmen z.B. ein Schmerzmittel ein oder gehen zum Arzt). Unter diesen Dimensionen des Schmerzes kann man bei Mensch und Tier arttypische motorische, vegetative, affektive und kognitive Elemente unterscheiden.
Die schmerzbezogenen nervösen Informationen lassen sich im Zentralnervensystem auf vielfache Weise modulieren, insbesondere durch Hemmungsvorgänge (Hemmung). Dabei werden im Gehirn und Rückenmark hemmende synaptische Überträgerstoffe (z.B. Opioidpeptide, Serotonin) verstärkt ausgeschüttet. Opioidpeptide (Opiatpeptide; z.B. Endorphine) reagieren als hemmende Neurotransmitter mit den Opioidrezeptoren (Opiatrezeptoren) an Nervenzellen des Zentralnervensystems. Ihre hemmende Wirkung auf Schmerzinformationen wird durch Morphin imitiert, da es von den Opioidrezeptoren z.B. der Rückenmarksneurone erkannt wird. Die Bindung des Morphins an die Opioidrezeptoren der Nervenzellen führt dazu, daß die Zahl der weitergeleiteten Nervenimpulse auf einen Schmerzreiz – und damit auch die Stärke des wahrgenommenen Schmerzes – kleiner wird. Außer den Opioidpeptiden gibt es noch andere hemmende Transmitter im Zentralnervensystem, die eine Verringerung von Schmerzinformation bewirken können. Die inhibitorischen Mechanismen im Zentralnervensystem lassen sich durch unterschiedliche Methoden wie zentral angreifende Analgetika (z.B. Morphin) oder Stimulationsverfahren (z.B. transcutane elektrische Nervenstimulation, Akupunktur, Physiotherapie) verstärkt aktivieren.
Schmerzchronifizierung
Grundlagenforschung und klinische Untersuchungen zeigen, daß Schmerzen zunehmend chronifizieren können. Dabei spielt v.a. eine Sensibilisierung des Nervensystems auf allen Ebenen eine Rolle, die bei vielen Schmerzkranken direkt nachgewiesen werden konnte. Für die chronische Übererregbarkeit der Nervenzellen wird ein zelluläres Schmerzgedächtnis verantwortlich gemacht. Offensichtlich führen länger anhaltende oder wiederholt auftretende Schmerzen zu einer Veränderung der neuronalen Funktionalität. Auf heftige Schmerzreize hin werden erregende Überträgerstoffe, wie Glutamat oder Substanz P, freigesetzt. Diese aktivieren die postsynaptische Nervenzelle, wobei z.B. die gleichzeitige Aktivierung von NMDA-Rezeptoren (für Glutamat als Transmitter; Glutamatrezeptoren) und NK1-Rezeptoren (für Substanz P) für eine Langzeitwirkung entscheidend ist. Calcium strömt ins Zellinnere oder wird aus intrazellulären Speichern freigesetzt, intrazelluläre Signalsubstanzen werden gebildet oder durch Phosphorylierung aktiviert. Schließlich werden induzierbare Gene aktiviert, die immediate early genes (IEG), wie c-fos (Fos) und c-jun (Jun). Die von den IEG codierten Proteine sind Transkriptionsfaktoren, die viele andere Gene regulieren. So kann es zu einer langdauernden Umstellung der Proteinsynthese in Nervenzellen kommen. Durch vermehrte Bildung von z.B. Ionenkanälen, erregenden Neurotransmittern und postsynaptischen Rezeptoren kann die Erregbarkeit der Nervenzellen langfristig erhöht werden, es kann zur Langzeitpotenzierung (LTP) bei der Übertragung von Schmerzinformation im Rückenmark kommen. Dabei spielen auch neue synaptische Verbindungen mit, die nach Schmerzreizung und Trauma u.a. auch durch Aussprossen von präsynaptischen Endknöpfchen vermehrt gebildet werden. Auch auf der Ebene des somatosensorischen Cortex kann man bei Mensch und Tier unter schmerzhafter Traumatisierung langdauernde plastische Veränderungen der topographischen Zuordnung zwischen Peripherie und Hirnrinde beobachten, die z.B. mit dem Auftreten von Phantomschmerz korreliert sind (Plastizität im Nervensystem). Die Schmerzchronifizierung wird durch zahlreiche körperliche und psychosoziale Risikofaktoren begünstigt, z.B. Intensität und Dauer von akuten Schmerzepisoden (z.B. durch Operation), Depressivität oder Angst vor wiederkehrenden Schmerzen, Enttäuschungen über fehlgeschlagene Schmerzbehandlungen und sekundäre Krankheitsgewinne durch Schmerzen.
Schmerz in der Medizin
In der Medizin werden Schmerzen zunächst entsprechend ihrer Dauer eingeteilt in 1) akute Schmerzen, bedingt durch Verletzung oder heilbare Krankheit (z.B. Blinddarmentzündung), wichtig als Zeichen zur Erkennung der Krankheit, und 2) chronische Schmerzen (ab ca. 3 Monaten Dauer), verursacht durch langwierige oder unheilbare Krankheiten (z.B. chronische rheumatische Erkrankungen, Krebs) oder ohne erkennbare körperliche Krankheitsursache bestehend. Auch häufig wiederkehrende Schmerzen (z.B. Migräne) werden zu den chronischen Schmerzen gerechnet.
Bei Schmerzen ohne erkennbare körperliche Krankheitsursache (z.B. manche Kopfschmerzen, Rückenschmerzen, Bauchschmerzen), können Fehlregulationen (sog. funktionelle Störungen) als Schmerzursache aufgedeckt werden (z.B. Fehlregulationen der Hirndurchblutung bei der Migräne, körperliche Fehlhaltungen bei Rückenschmerzen; s.o.). Auch psychosomatische Vorgänge (oft ebenfalls als funktionelle Störungen bezeichnet) können zu Schmerzen führen, die z.T. über Wirkungen der Psyche auf das vegetative Nervensystem (z.B. Sympathicus-Aktivierung bei Angst) oder auf das skelettmotorische Nervensystem (z.B. Muskelverspannung bei emotionalem Streß) erklärt werden. Schmerzen unterliegen auch verstärkenden Einflüssen aus dem sozialen Bereich; dazu gehören unbewältigte soziale Konflikte (z.B. in der Partnerschaft) oder sekundärer Krankheitsgewinn (z.B. bei vermehrter Zuwendung als Reaktion auf Schmerzverhalten).
Chronische Schmerzen können für den Betroffenen zum quälenden Leiden werden, sie beherrschen sein Denken und Handeln und bedeuten oft eine drastische Einschränkung seiner Lebensqualität. Unerträgliche Schmerzen können bis zum Suizid führen. Häufige Arten chronischer Schmerzen sind z.B. Kopfschmerzen (vor allem Migräne), rheumatische Schmerzen, Gelenk- und Rückenschmerzen, Nervenschmerzen, z.B. nach Bandscheibenvorfall oder bei Diabetes mellitus, Schmerzen durch eine Krebserkrankung (Krebsschmerz) und Schmerzen bei Amputierten.
Schmerz verursacht auch erhebliche volkswirtschaftliche Einbußen: Die Kosten durch Arbeitsausfälle, Frühinvalidität und medizinische Behandlung werden in Deutschland auf 80 Milliarden DM jährlich geschätzt.
Schmerzmessung (Algesimetrie)
Bei experimentellen Schmerzreizen oder klinischen Schmerzen können die Schmerzwahrnehmungen vom Betroffenen in mehreren Dimensionen beschrieben werden. So läßt sich die Schmerzintensität z.B. auf einer visuellen Analogskala angeben, die Schmerzqualität durch Auswahl aus einer Liste schmerzbeschreibender Eigenschaftswörter, der Schmerzort durch Markierung in einer Umrißzeichnung des Körpers. Diese Messung ist naturgemäß subjektiv, eine objekive Messung (z.B. durch Ableitung der Hirnströme) ist bisher bei kurzdauernden experimentellen Schmerzreizen, nicht jedoch im Bereich der klinischen Schmerzen möglich. Die Subjektivität ist jedoch eher von Vorteil, da so der Schmerz in seiner Leidensrelevanz dokumentiert wird. Der Wert der Schmerzmessung (Algesimetrie) liegt vor allem in der Möglichkeit, die Wirksamkeit einer Schmerzbehandlung zu dokumentieren. In der Medizin werden zunehmend standardisierte Schmerzfragebögen und -tagebücher eingesetzt.
Schmerzpsychologie
Bei Wahrnehmung und Erleben von Schmerzen spielt eine Vielfalt psychologischer Faktoren mit, die auch für die Schmerzbehandlung (s.u.) ausgenutzt werden können und sollen. Die Abläufe können dabei in drei Dimensionen beschrieben werden: 1) sensorisch-diskriminativ, d.h. Wahrnehmung eines Schmerzreizes; 2) affektiv-motivational, d.h. Gefühls- und Antriebswirkung; 3) kognitiv-evaluativ, d.h. verstandesmäßige Einordnung, Bewertung und Reaktion. Schmerzverarbeitung und Schmerzerleben hängen ab von früheren Erfahrungen, sie werden durch überwiegend unbewußte Lernvorgänge bestimmt. Auch Modell-Lernen an den Reaktionen anderer ist wichtig; Kinder lernen Schmerzverhalten besonders von ihren Eltern. Schließlich ist das soziokulturelle Wertesystem auch von prägender Wirkung auf das Schmerzerleben; so kann man die unterschiedlichen Verhaltens- und Erlebnisweisen in Schmerzsituationen bei Angehörigen verschiedener Volksgruppen verstehen, z.B. in der christlich-abendländischen und in der buddhistisch-asiatischen Welt.
Der Schmerz hängt stark vom Selbstkonzept eines Menschen ab, d.h. von der Art, wie er seinen Körper und dessen Krankheit sieht und in ein Erklärungssystem einordnet und welche Überzeugung er über die Kontrolle seiner körperlichen und seelischen Kräfte und Funktionen hat. Das Fehlen einer Kontrollüberzeugung, auch als gelernte Hilflosigkeit bezeichnet, begünstigt die Chronifizierung und Schwere eines Schmerzverlaufs. Auch die sozialen Fertigkeiten eines Menschen sind Teil des Selbstkonzepts und für Entstehung und Erleben von Schmerz eine wichtige Einflußgröße.
Situationsabhängige Einflüsse auf den Schmerz beruhen darauf, daß das Nervensystem wegen seiner beschränkten Kapazität bewußter Vorgänge unter der Vielzahl äußerer und innerer Reize auswählen muß. Die Aufmerksamkeit kann so auf den Schmerz hin oder von ihm weg gerichtet sein. Auch die Erwartungshaltung vor Eintritt eines Schmerzzustands bestimmt das tatsächliche Schmerzerlebnis, z.B. bei postoperativem Schmerz.
Alle diese Einflußfaktoren können durch Training systematisch und gezielt so verändert werden, daß die Erfahrung des Schmerzes für den Betroffenen gemildert wird (Schmerzbewältigungstraining). Die entsprechenden psychologischen Interventionen werden unter dem Konzept der Verhaltensmedizin des Schmerzes zusammengefaßt (Ethomedizin).
Schmerzbehandlung
Aus den obengenannten Punkten lassen sich verschiedene Ansätze und Methoden zur Schmerzbehandlung ableiten ( siehe Tab. ). Auf jeden Fall sind Schmerzen für den Patienten immer eine Realität, was vom Therapeuten anerkannt werden muß. Psychosoziale Schmerzfaktoren müssen im Anamnesegespräch erkannt und bei der Behandlung berücksichtigt werden. Patienten mit chronischen Schmerzen müssen auch psychotherapeutisch angegangen werden, z.B. durch Entspannungstraining oder kognitive Verhaltenstherapie. Auch die Schmerzbewältigung des Patienten durch Aktivierung seines Potentials zur Meisterung seiner Situation sollte ein unverzichtbarer Bestandteil einer interdisziplinären Versorgung von Patienten mit chronischen Schmerzen sein. Bei diesen neueren Ansätzen hat sich die Arbeit in Patientengruppen unter Anleitung als effizient erwiesen. – Durch Kombination der Behandlung auf mehreren Ebenen und interdisziplinäre Zusammenarbeit z.B. verschiedener Fachärzte, Psychologen, Krankengymnasten und Sozialarbeitern kann der Erfolg einer Schmerztherapie gesteigert werden. Zur Dokumentation der Wirksamkeit einer Schmerztherapie ist die Schmerzmessung mit einem Schmerztagebuch unverzichtbar.
Schmerzmedikamente werden nach ihren Wirkungsmechanismen in Opioide und Nichtopioide eingeteilt. Nichtopioide (z.B. Acetylsalicylsäure, Ibuprofen, Paracetamol, Metamizol) wirken v.a. hemmend auf die Nozizeptoren und z.T. auf die Synthese von Schmerz- und Entzündungsmediatoren (z.B. Prostaglandine, Cytokine). Zusätzlich zu diesen entzündungshemmenden Mechanismen wirken sie außerdem fiebersenkend, spasmolytisch und Thrombocyten-aggregationshemmend und können somit zur Differentialindikation bei verschiedenen Arten schmerzhafter Erkrankungen ausgenutzt werden. Entzündungshemmende Nichtopioide können auch bei starken Schmerzen wirksam sein, z.B. bei Knochentumoren oder Bandscheibenvorfall. Sie müssen jedoch ausreichend hoch dosiert werden. Bei längerdauerndem Gebrauch können unerwünschte Nebenwirkungen auftreten, z.B. Magenblutungen, allergische Reaktionen (Asthma), Leberschäden und Schäden der Blutbildung. Die Nebenwirkungen sind meistens reversibel und können z.B. durch Präparatwechsel weitgehend vermieden werden. Für die meisten Nebenwirkungen können Risikopatienten und -situationen identifiziert werden (z.B. Magengeschwüre, ältere Patienten, Asthma), bei denen entweder neuartige Nichtopioide, die selektiven COX-2-Hemmer, oder Opioide vorzuziehen sind. Die Auftrittswahrscheinlichkeiten schwerer Nebenwirkungen sind eher niedrig (z.B. 1 Fall von Blutbildungsstörung pro 1 Million Anwendungen von Metamizol), was besonders beim Vergleich mit anderen Risiken des täglichen Lebens (Verkehrsunfall, Gesundheitsschädigung durch Rauchen) gering erscheint.
Die Opioide haben einen überwiegend zentralnervösen Wirkungsmechanismus, zu ihnen gehören Morphin, Buprenorphin, L-Methadon, Oxycodon, Fentanyl, Tilidin und Tramadol (Opiate). Sie wirken über Opioidrezeptoren in Gehirn und Rückenmark und hemmen so die neurale Schmerzinformation. Bei chronischen Schmerzen ist, entsprechend dem WHO-Stufenschema, eine stetige Zufuhr des Analgetikums notwendig. Diese läßt sich erreichen durch regelmäßige orale Einnahme oder durch Zufuhr des Opioids durch die Haut aus einem als Pflaster aufgebrachten Medikamentenreservoir (z.B. Fentanyl- oder Buprenorphinpflaster). Zur oralen Einnahme sind v.a. Retardpräparate für den Patienten günstig, die es für Opioide und Nichtopioide gibt. Eine Gabe erst bei Wiederauftreten von Schmerzen (Gabe nach Bedarf) belastet den Patienten und ist bei chronischen Schmerzen abzulehnen. Reicht die orale oder transdermale Gabe bei extrem starken Schmerzen nicht aus, kann Morphin durch einen Katheter in das Rückenmark oder in die Hirnkammern appliziert werden, wobei mit einer kompakten trag- oder implantierbaren Pumpe eine gleichmäßige Infusion durchgeführt werden kann. Besonders die starken Opioide können zur körperlichen Abhängigkeit führen, erkennbar an den vorübergehend auftretenden Entzugssymptomen beim Absetzen des Medikaments. Bei regelmäßiger Gabe (nach Zeitschema), wie bei chronischen Schmerzen erforderlich, ist eine körperliche Abhängigkeit jedoch unbedeutend, da wegen der ständigen Opioidzufuhr kein Entzugssymptom auftreten kann.
Auch Medikamente, die nicht zu den verschiedenen Gruppen von Analgetika gehören, können zur Behandlung bestimmter Schmerzarten eingesetzt werden, z.B. Psychopharmaka, Antikonvulsiva, Kreislaufmittel und Hormone. Sie können allein oder in Kombination mit Analgetika eingesetzt werden. – Unter den Psychopharmaka wirken vor allem die tricyclischen Antidepressiva günstig auf Schmerzen, besonders auf Nervenschmerzen. Die Wirkung beruht nicht nur auf einer emotionalen Schmerzdistanzierung und Stimmungsaufhellung, sondern es besteht auch eine direkte schmerzdämpfende Wirkung, die z.B. über die Verlängerung der Wirkungsdauer der schmerzhemmenden Neurotransmitter Serotonin und Noradrenalin erklärt wird. Die Dosierungen sind niedriger als zur Behandlung einer Depression. – Unter den Kreislaufmedikamenten werden Beta-Blocker und Calcium-Antagonisten zur Langzeitbehandlung der Migräne eingesetzt. Durch diese Migräneprophylaxe gehen Häufigkeit und Schwere der Migräneanfälle zurück. Als Wirkmechanismus wird eine Stabilisierung und Normalisierung fehlregulierter Blutgefäße im Gehirn angenommen. Neuere Migränemittel sind die Triptane (z.B. Sumatriptan, Zolmitriptan), mit denen auch bei Unwirksamkeit erprobter klassischer Medikamente (z.B. Acetylsalicylsäure, Paracetamol, zur Beschleunigung des Wirkungseintritts auch mit Coffein oder Kohlensäure kombiniert) ein Migräneanfall erfolgreich abgebrochen werden kann. – Antikonvulsiva sind Medikamente, die übererregbare Nervenzellen des Gehirns dämpfen und deshalb vor allem bei der Behandlung der Epilepsie verwendet werden. Unter ihnen hat sich besonders das Carbamazepin bei der Trigeminusneuralgie (plötzlich einschießende stärkste Schmerzen im Gesicht) als wirksam erwiesen. Ein neueres Medikament dieser Gruppe ist das Gabapentin. – Schmerzen bei hormonabhängigen Mamma- und Prostatakarzinomen sprechen gut auf bestimmte Sexualhormone an. Calcitonin, ein Hormon des Calciumstoffwechsels, wirkt sich günstig bei Schmerzen durch Knochenerkrankungen (z.B. Osteoporose, Knochentumoren) aus, ebenso die den Knochenabbau hemmenden Bisphosponate. Corticosteroide sind bei Schmerzzuständen wirksam, bei denen Schwellungs- und Druckzustände beteiligt sind, z.B. bei Hirntumoren oder Nervenkompression. Anästhesie, Betäubung, Narkotika.
Lit.: Basler, H.D. et al. (Hrsg.): Psychologische Schmerztherapie. Heidelberg 1999. Kutzer, K.: Das Recht auf Schmerzbehandlung. Der Schmerz 5, 1991. Schultz, H.J. (Hrsg.): Schmerz. Stuttgart 1990. Wall, P.D., Melzack, R. (Hrsg.): Textbook of Pain. Edinburgh 1994. Zenz, M., Jurna, I. (Hrsg.): Lehrbuch der Schmerztherapie. Stuttgart 1993. Zimmermann, M., Handwerker, H.O. (Hrsg.): Schmerz – Konzepte, ärztliches Handeln. Heidelberg 1984. Zimmermann, M., Seemann, H.: Der Schmerz – ein vernachlässigtes Gebiet der Medizin? Defizite und Zukunftsperspektiven in der Bundesrepublik Deutschland. Heidelberg 1986.
Schmerz
1 In der Medizin unterscheidet man viscerale und somatische Schmerzempfindungen. Die visceralen Schmerzen betreffen die dumpfen Schmerzempfindungen der Eingeweide (Eingeweideschmerz, z.B. Gallenkoliken, Blinddarmentzündungen). Beim somatischen Schmerz unterscheidet man Tiefen- und Oberflächenschmerz. Beim Tiefenschmerz handelt es sich um dumpfe Schmerzempfindungen, die meist schlecht lokalisierbar sind und in die Umgebung ausstrahlen. Diese betreffen Bindegewebe, Muskeln, Knochen und Gelenke. Zu ihnen gehört die wohl häufigste Schmerzform des Menschen, der Kopfschmerz. Tiefenschmerzen gehen mit motorischer Hemmung, Schonstellung (z.B. bei Knochenbrüchen) und passivem Zusammensinken einher. Der von der Haut ausgehende Oberflächenschmerz ist eine helle, gut lokalisierbare Empfindung, die nach Aufhören des Reizes schnell abklingt (erster Schmerz). Sie löst entsprechend gerichtete Reaktionen aus, wie Abwehr oder Flucht. Bei hoher Reizintensität mit einer Dauer von mehr als 0,5-1 s folgt eine zweite Schmerzphase von dumpfem, brennendem Charakter, die langsam abklingt und schwer lokalisierbar ist (zweiter Schmerz).
Schmerz
2 Nozizeptoren sind freie Nervenendigungen mit dünnen markhaltigen oder marklosen Nervenfasern, die auch unterschiedliche Schmerzqualitäten weiterleiten. An den hellen Schmerzempfindungen sind die markhaltigen Nervenfasern beteiligt, an den schwer erträglichen dumpfen, brennenden Schmerzen die marklosen. In der Haut wurden bisher rein mechanosensitive, rein thermosensitive sowie mechano- und thermosensitive Schmerzrezeptoren gefunden (Mechanorezeptoren, Thermorezeptoren). Nozizeptoren, die beide Qualitäten erfassen, scheinen häufiger zu sein als die beiden anderen Typen. In den Hohlorganen der Eingeweide sind mechanosensitive Nozizeptoren zu finden. Sie reagieren zum Teil auf passive Dehnung und zum Teil auf aktive Kontraktion der glatten Muskulatur. Auch fehlende Durchblutung (Ischämie) und bestimmte Gase oder Staubpartikel in der Lunge können zu Schmerzempfindungen führen. In der Skelettmuskulatur kommen chemo- und mechanosensitive Rezeptoren vor.
Schmerz
3 Schmerzmediatoren werden bei Schädigungen des Gewebes freigesetzt und lösen den Schmerzreiz an den freien Nervenendigungen aus. So wirken winzige Flüssigkeitsmengen aus Brandblasen der Haut stark schmerzerzeugend. Bekannte Schmerzstoffe sind Acetylcholin, Histamin, Serotonin (entsteht durch Zerfall von Blutplättchen) und Plasmakinine (entstehen aus dem Blutplasma und sind in Brandblasen und in durch Entzündungen abgesonderten Flüssigkeiten zu finden). Diese Stoffe sind teilweise auch in Brennesseln und in Bienengift enthalten. Lokale Erhöhungen der Konzentration von H+- und K+-Ionen rufen ebenfalls Schmerzempfindungen hervor.
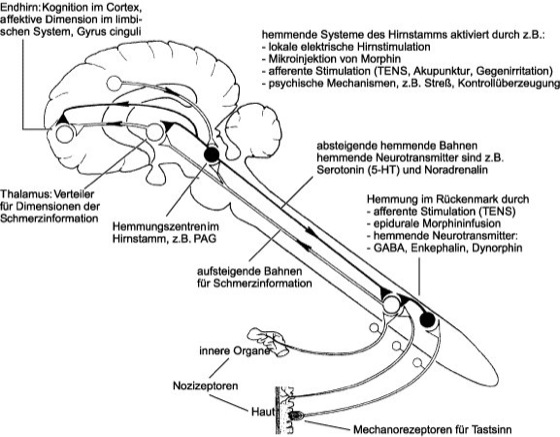
Schmerz
Stark vereinfachte anatomisch-funktionelle Übersicht über das Schmerzsystem.
Erregungen aus Nozizeptoren werden auf Rückenmarksneurone umgeschaltet. Die Konvergenz von Haut- und Eingeweide-Afferenzen dort erklärt die Head-Zonen. Schmerzinformation wird im Rückenmark durch lokale und absteigende Hemmungssysteme kontrolliert. Aufsteigende Schmerzbahnen leiten die Schmerzinformation zum Gehirn, dort erfolgt die Einbindung in die vegetative Regulation (Hirnstamm, Hypothalamus), die kognitive (Cortex) und affektive (limbisches System, v.a. Gyrus cinguli) Verarbeitung und die Wahrnehmung. Hemmungssysteme, die v.a. im Hirnstamm gut untersucht sind, werden durch viele Schmerztherapieverfahren vermehrt aktiviert. Eine Funktionsschwäche der Schmerzhemmung im ZNS trägt zur erhöhten Schmerzempfindlichkeit und zum chronischen Schmerz bei.
Schmerz
Ansätze zur Schmerzbehandlung:
- Beseitigung oder Verringerung der Schmerzursache
- Hemmung der Nozizeptoren
- Blockade der Nervenleitung
- Hemmung der zentralnervösen Schmerzinformation
- Beseitigung nervöser und neurohumoraler Fehlregulationen
- Beeinflussung des Schmerzerlebens
Derzeit gängige Methoden zur Schmerzbehandlung (je nach Schmerzursache):
- nichtopioide Analgetika
- periphere Neurostimulationsverfahren (transcutane elektrische Nervenstimulation, Akupunktur)
- physikalische Therapie, Manualtherapie, Krankengymnastik
- verhaltensmedizinische Ansätze
- Nervenblockaden mit Lokalanästhetika
- Grenzstrangblockade mit Lokalanästhetika
- Psychopharmaka (besonders Antidepressiva)
- Medikamente mit indirekter analgetischer Wirkung (Calcium-Antagonisten, Beta-Blocker, Calcitonin, Bisphosphonate, Antikonvulsiva)
- zentralnervös angreifende Analgetika
- neurolytische Nerven- oder Grenzstrangblockaden
- Rückenmarks- oder Hirnstimulation
- neurochirurgische Schmerzoperationen
- psychologische und verhaltensmedizinische Schmerztherapie
- Stärkung der Fähigkeit des Patienten zur Schmerzbewältigung
Schreiben Sie uns!