Login erforderlich
Dieser Artikel ist Abonnenten mit Zugriffsrechten für diese Ausgabe frei zugänglich.
mikro-RNA: Wächter des Gedächtnisses
Die Neurowissenschaftler Gabriele Siegel und Gerhard Schratt ergründen die Geheimnisse einer erst in jüngerer Zeit entdeckten Gruppe von Molekülen: der mikroRNAs. Die winzigen Erbgutschnipsel spielen offenbar eine zentrale Rolle bei der Gedächtnisbildung. Fallen sie aus, können sogar neuropsychiatrische Erkrankungen die Folge sein.
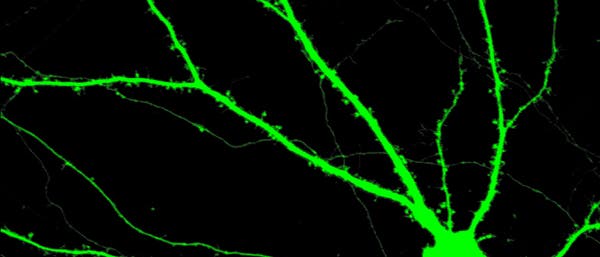
© Mit frdl. Gen. von Gabriele Siegel (Ausschnitt)
Im März 2004 stellte Daniel Tammet einen neuen Europarekord auf. Der Brite gab die Kreiszahl Pi bis auf sage und schreibe 22 514 Stellen nach dem Komma aus dem Gedächtnis wieder. Tammet ist einer von weltweit etwa 600 Savants – Menschen mit außergewöhnlichen Fähigkeiten, die sich aber nur auf ein bestimmtes Gebiet beschränken. Sein Beispiel veranschaulicht eindrucksvoll, was passiert, wenn das Gehirn sein Potenzial ungebremst entfaltet.
Als entscheidende Strukturen für solche Leistungen gelten die Synapsen – spezialisierte Verknüpfungen, über welche die Nervenzellen miteinander kommunizieren. Der US-amerikanische Neurobiologe und Nobelpreisträger Eric Kandel von der Columbia University in New York entdeckte in den 1990er Jahren bei der Meeresschnecke Aplysia californica, dass die Langzeitspeicherung neuer Eindrücke zu dauerhaftem Wachstum und zur Neubildung von Synapsen führt (siehe G&G 4/2006, S. 62). Eine derart veränderte Synapse reagiert auf einen nachfolgenden Reiz anders – sie "erinnert" sich. Dieser als synaptische Plastizität bezeichnete Vorgang gilt als zentraler Mechanismus für die Gedächtnisspeicherung bei allen höheren Lebewesen.
Damit das funktioniert, benötigen Synapsen eine ganze Maschinerie aus verschiedenen Proteinen ...
Als entscheidende Strukturen für solche Leistungen gelten die Synapsen – spezialisierte Verknüpfungen, über welche die Nervenzellen miteinander kommunizieren. Der US-amerikanische Neurobiologe und Nobelpreisträger Eric Kandel von der Columbia University in New York entdeckte in den 1990er Jahren bei der Meeresschnecke Aplysia californica, dass die Langzeitspeicherung neuer Eindrücke zu dauerhaftem Wachstum und zur Neubildung von Synapsen führt (siehe G&G 4/2006, S. 62). Eine derart veränderte Synapse reagiert auf einen nachfolgenden Reiz anders – sie "erinnert" sich. Dieser als synaptische Plastizität bezeichnete Vorgang gilt als zentraler Mechanismus für die Gedächtnisspeicherung bei allen höheren Lebewesen.
Damit das funktioniert, benötigen Synapsen eine ganze Maschinerie aus verschiedenen Proteinen ...

Schreiben Sie uns!
Beitrag schreiben