Gentechnologie: Alte Feinde, neue Waffen
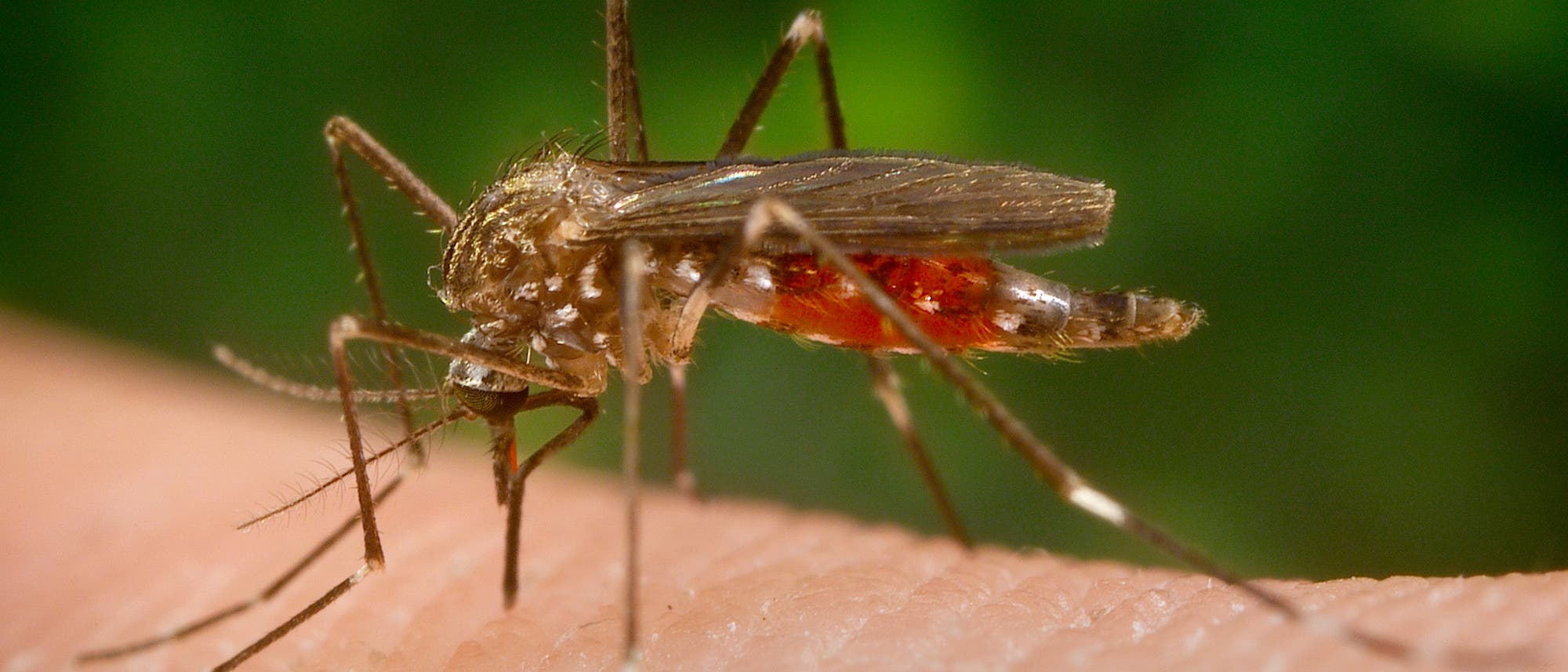
"2015 soll die Zahl der Todesfälle durch Malaria gegen Null gehen", proklamierte die WHO anlässlich des Weltmalariatages im April 2012. Damit hat sie sich ein ehrgeiziges Ziel gesetzt, denn mit geschätzten 1,2 Millionen Opfern im Jahr ist Malaria immer noch eine sehr häufige Todesursache in Entwicklungs- und Schwellenländern. Zwar wird mittlerweile intensiv an verbesserten Medikamenten und Impfstoffen gegen die Tropenkrankheit geforscht. Doch die Wirksamkeit der aktuell besten Therapie mit einem Artemisinin-Kombinationspräparat lässt bereits nach. Zu RTS,S, dem ersten von 50 ernst zu nehmenden Impfstoffkandidaten, die sich momentan in der Entwicklung befinden, laufen aktuell klinische Studien mit größeren Personengruppen. Vorläufigen Ergebnissen zufolge liegt die Wirksamkeit des Impfstoffs allerdings bei unter 50 Prozent.
Imprägnierte Moskitonetze, die von allen Maßnahmen am besten dabei helfen könnten, Malaria in Schach zu halten, stehen in Risikogebieten nicht überall in ausreichendem Maße zur Verfügung. Mehrere Forschergruppen verfolgen den Ansatz, männliche Vertreter der Anopheles-Mücke genetisch so zu verändern, dass sie sich nicht mehr fortpflanzen können. Da Anopheles-Weibchen den Malariaerreger Plasmodium falciparum übertragen, könnte man dessen Verbreitung so eindämmen. Das Ausbringen genetisch veränderter Mücken bringt jedoch ökologische Risiken mit sich und ist unweigerlich mit umfangreichen ethischen Debatten verbunden – wie am Beispiel des Überträgers von Denguefieber, Stegomyia aegypti, unlängst deutlich wurde.
Um durch Mücken übertragene Infektionskrankheiten einzuschränken, gibt es jedoch noch eine weitere Strategie, die zumindest im Labor funktioniert: Wissenschaftler wollen gegen die Erreger direkt vorgehen – mit genetisch veränderten Bakterien. Diese sind so programmiert, dass sie im Mückendarm ein Gift freisetzen, welches die Erreger abtötet, sobald sie sich dort einnisten. Da die Toxine so gewählt werden können, dass sie den Mücken keinen Schaden zufügen, fallen zumindest die ökologischen Risiken ungleich geringer aus als beim Aussetzen genetisch veränderter Mücken. Bereits 1997 hatten Forscher im Laborversuch gezeigt, dass Rhodococcus-rhodnii-Bakterien im Darm von Raubwanzen Trypanosoma cruzi abtöten können, den Erreger der in Südamerika verbreiteten Chagas-Krankheit – allerdings ohne in der Zwischenzeit einen Freilandversuch durchzuführen [1]. Kürzlich wiesen Wissenschaftler um Marcelo Jacobs-Lorena vom John Hopkins Malaria Research Institute in Baltimore nach, dass derselbe Trick auch beim Malariaerreger Plasmodium falciparum funktioniert [2]. "Hiermit haben wir die Basis dafür geschaffen, genetisch veränderte Bakterien als effektive Waffen im Kampf gegen Malaria einzusetzen", freuten sich daraufhin die Autoren.
Wie viel Potenzial steckt wirklich in den ersten Laborversuchen mit gentechnisch veränderten Bakterien, daraus ein wirksames Mittel gegen von Mücken übertragene Infektionskrankheiten zu entwickeln? Und welche Risiken gilt es trotz allem zu beachten?
Die Suche nach einem Bakterium, das sich als Mordwaffe für Plasmodium eignet
Viele tropische Infektionskrankheiten wie Malaria, Schlafkrankheit oder Leishmaniose werden von Protozoen ausgelöst, einfachen Organismen mit komplexen Lebenszyklen. Hierzu zählt auch der Verursacher der Malaria, Plasmodium falciparum. Dieser kann sich im Säugetierblut sehr schnell vermehren, was in regelmäßigen Abständen zu den malariatypischen Fieberschüben führt. Hierbei vermehren sich die Plasmodien ungeschlechtlich durch Teilung. Nach einigen Teilungszyklen bilden sie jedoch männliche und weibliche Keimzellen aus, die darauf angewiesen sind, in den Darm einer Anopheles-Mücke zu gelangen, um dort miteinander verschmelzen und sich zu einer Oozyste weiter entwickeln zu können. In der Oozyste wachsen als Produkt der geschlechtlichen Fortpflanzung neue asexuelle Nachkommen der Plasmodien heran, so genannte Sporozoiten. Mit der nächsten Blutmahlzeit der Mücke befallen die Sporozoiten den nächsten Wirtsorganismus.
Mit der Entwicklung von Oozyste und Sporozoiten finden die empfindlichsten Stadien im Lebenszyklus der Plasmodien im Mückendarm statt. Deswegen setzen Forscher auch genau dort mit ihren Versuchen an, die Erreger mit gentechnisch veränderten Bakterien zu bekämpfen. Hierbei bauten Jacobs-Lorena und Kollegen zunächst auf Escherichia coli, das sich leicht genetisch manipulieren lässt. 2007 fassten sie ihre Ergebnisse in einer Publikation zusammen [3]: Den Wissenschaftlern war es gelungen, ein Gen in E. coli einzuschleusen, das bewirkt, dass das Bakterium ein Peptid namens SM1 produziert und an seine Oberfläche bringt. Im Mückendarm blockiert SM1 eine Bindungsstelle, die kritisch dafür ist, dass Plasmodium die Darmwand durchdringen und sich dort festsetzen kann. Die genetisch veränderten Bakterien brachten die Forscher in die Mücken, indem sie diese erst aushungerten und ihnen dann eine mit den Zellen angereicherte Pufferlösung vorsetzten. Als sie die Mücken anschließend mit Plasmodien infiziertes Blut saugen ließen, entwickelten sich im Darm der Insekten, die SM1-produzierende Bakterien enthielten, bis zu 41 Prozent weniger Oozysten als in der Kontrollgruppe.
Die Wissenschaftler interpretierten dieses Ergebnis als Beweis dafür, dass ihre Methode prinzipiell funktioniert. Allerdings stießen sie auf das Problem, dass E. coli im Mückendarm nur für wenige Tage überlebt. Aus diesem Grund suchten die Forscher nach einem Ersatzbakterium, das natürlicherweise im Darm von Anopheles vorkommt. Ihre Wahl fiel auf Pantoea agglomerans, das Objekt der Folgestudie, deren Ergebnisse die Gruppe um Jacobs-Lorena im Juli 2012 veröffentlichte [2].
"Wir haben die Basis dafür geschaffen, genetisch veränderte Bakterien als effektive Waffen im Kampf gegen Malaria einzusetzen"
Marcelo Jacobs-Lorena
Dieser Austausch des Bakteriums erwies sich als Schlüssel zum Erfolg, denn genetisch veränderte Pantoea-agglomerans-Bakterien konnten die Forscher noch eine Woche nach der Verabreichung im Darm der Anopheles-Mücken nachweisen. Dieses System nutzten sie nun, um neben dem SM1-Peptid die Effektivität von sieben weiteren gegen Plasmodium wirksame Toxinen zu testen. Am erfolgreichsten schnitt dabei eine vierfache Kopie des Peptids EPIP (Plasmodium enolase-plasminogen interaction peptide) ab, das einen ähnlichen Wirkmechanismus hat wie SM1: 32 Stunden nach der plasmodienhaltigen Blutmahlzeit identifizierten die Wissenschaftler im Darm der Insekten, denen sie zusätzlich EPIP-produzierende Bakterien verabreicht hatten, insgesamt 98 Prozent weniger Oozysten als in der Kontrollgruppe. Der Prozentsatz der Moskitos, die mindestens eine Oozyste trugen, ging von 90 auf 14 Prozent zurück. Außerdem konnten die Forscher zeigen, dass die Methode nicht nur gegen Plasmodium falciparum wirkt, den häufigsten Erreger von Malaria beim Menschen. Auch die Zahl der Oozysten von Plasmodium berghei, der Nagetiere befällt, fiel im Darm von mit Bakterien "geimpften" Stechmücken deutlich geringer aus als in unbehandelten Mücken. Den Insekten konnten die genetisch veränderten Bakterien offenbar nicht viel anhaben: Beim Vergleich der Lebensspanne von Mücken mit und ohne gentechnisch veränderte Bakterien im Darm stellten die Forscher keine signifikanten Unterschiede fest.
Die Ergebnisse aus dem Labor scheinen also überaus viel versprechend. Doch welche Möglichkeiten ergeben sich hieraus für die Praxis? Kann man tatsächlich gentechnisch veränderte Bakterien ins Freiland bringen und so die Malaria bekämpfen?
Kritik an der Laborstudie
Friedrich Frischknecht, Leiter einer Arbeitsgruppe, die an der Universität Heidelberg zum Thema Malaria forscht, sieht noch weiteren Experimentierbedarf, bevor ihm eine Anwendung dieser Strategie praktikabel erscheint: "Die Arbeit von Jacobs-Lorena und Kollegen markiert einen kleinen Schritt in die richtige Richtung", so Frischknecht. In der Studie fehle seiner Meinung nach allerdings ein wichtiges Kontrollexperiment: "Die Autoren haben nicht gezeigt, wie effektiv eigentlich die Rücktransmission auf eine Maus ist. Sie hätten zusätzlich noch testen müssen, ob die Stechmücken, die weniger Oozysten haben, auch nicht so viele Sporozoiten produzieren, die mit dem Speichel auf Menschen oder Mäuse übertragen werden." Denn nur wenn die mit gentechnisch veränderten Bakterien gefütterten Mücken auch weniger Sporozoiten verbreiten, könne man sagen, dass die Methode funktioniere.
Sicherheitsbedenken kommen hinzu
Auch Christoph Tebbe, Professor am Johann Heinrich von Thünen-Institut in Braunschweig, sieht den Ansatz, genetisch veränderte Darmbakterien zur Malariabekämpfung einzusetzen, noch im Pionierstadium. Grund sind Bedenken, dass sich Pantoea agglomerans, mit dem die Wissenschaftler ihre Laborversuche durchgeführt hatten, auch tatsächlich für ein Freilandexperiment eignet. "Zunächst sollte man wissen, ob das verwendete Bakterium auch spezifisch für Anopheles-Mücken ist und nicht auf den Darm anderer Insekten übertragen werden kann", mahnt er. Manche Insekten könnten nämlich auch nützliche Protozoen als Symbionten besitzen, die durch das Toxin unerwünscht geschädigt würden. Pantoea agglomerans würde dann als Überträger wohl ausscheiden. Vielversprechender, so Tebbe, wäre es möglicherweise, als Wirtsbakterium ein endosymbiontisches Bakterium wie Wolbachia zu verwenden, da dies die Übertragung auf andere Insekten verhindern könnte.
Die unbeabsichtigte Verbreitung der gentechnischen Veränderung könnte auch dadurch stark eingeschränkt werden, dass das Fremdgen in das Bakterienchromosom eingebaut würde. Jacobs-Lorens und Kollegen hatten das Gen in ein Plasmid eingebracht, also ein zum Chromosom zusätzliches Stück ringförmiger DNA. Plasmide geben Bakterien aber leicht wieder ab, wenn darauf kein Gen für ein lebensnotwendiges Protein kodiert ist. Als Bestandteil des Chromosoms, auf dem der größte Teil der Bakterien-DNA liegt, wäre das Fremdgen enger mit dem Bakterium verbunden und die Gefahr eines unerwünschten Gentransfers minimiert.
Dass gentechnisch veränderte Bakterien überhaupt dauerhaft im Freiland überleben können, hatte Tebbe bereits vor mehr als zehn Jahren gezeigt. Zu diesem Zweck hatte er in Bodenbakterien der Art Sinorhizobium meliloti das für Luciferase kodierende luc-Gen eingebaut. Das luc-Gen bewirkt, dass sich damit ausgestattete Bakterien durch ein Leuchten verraten, wenn man ihnen im Labor Luciferin zusetzt. Mit Hilfe dieses Tricks konnten die Forscher die gentechnisch veränderten Bakterien mehr als sieben Jahre später zwar in geringerer Zahl, aber durchaus noch problemlos im Freiland nachweisen.
Die größten Probleme sind praktischer Art
"Toxinproduzierende Bakterien könnten durchaus bei der Bekämpfung der Malaria helfen, sofern sie gezielt die Entwicklung der Plasmodien hemmen", schätzt Jürgen May die Lage ein. May leitet am Hamburger Bernhard-Nocht-Institut für Tropenmedizin die Arbeitsgruppe Infektionsepidemiologie. Abgesehen von generellen Sicherheitsbedenken, genetisch veränderte Organismen auszusetzen, warnt er davor, die Schwierigkeiten zu unterschätzen, die bei der praktischen Umsetzung noch hinzukämen. Jacobs-Lorena und Kollegen schlagen vor, die genetisch veränderten Bakterien mit Zuckerwasser zu mischen und Baumwollkugeln mit dieser Lösung zu tränken. Die Baumwollkugeln sollen dann um von Malaria geplagte Dörfer herum in Marmeladengläsern ausgelegt werden. So sollen die Mücken die genetisch veränderten Bakterien zusammen mit dem Zuckerwasser aufnehmen.
Bakterien in großem Stil in geografisch breiten Gebieten auszusetzen, wie es für eine effektive Bekämpfung der Seuche nötig wäre, würde in der Praxis allerdings eine extreme Herausforderung bedeuten. "Das sieht man auch bei nicht gentechnisch veränderten Bacillus-thuringiensis-Bakterien, die Larven der Überträgermücke Anopheles abtöten können", erläutert May. So gebe es bis heute noch kein gutes Rezept dafür, Bacillus thuringiensis in so großer Zahl in die Gewässer zu bringen, in denen sich Anopheles vermehrt, dass man dadurch die Zahl der Malariaerkrankungen deutlich dezimieren könnte.
Der Kampf gegen Malaria und ähnliche Infektionskrankheiten ist also nicht nur eine Herausforderung für Naturwissenschaftler und Mediziner. Ebenso sind Vertreter aus Logistik und Politik gefragt, mit guten Ideen und innovativen Herangehensweisen dazu beizutragen, Infektionskrankheiten von ihrem Spitzenplatz an der Liste der häufigsten Todesursachen zu verdrängen.

Schreiben Sie uns!
1 Beitrag anzeigen