Chemische Reaktionen : Beliebte Beschleuniger-Ecken
Bestimmte chemische Reaktionen mögen bestimmte Oberflächen gerne - und andere, eigentlich identisch aufgebaute, wieder gar nicht. Warum das so ist, bleibt zwar noch rätselhaft, verrät sich aber vielleicht bald per Leuchtsignal.
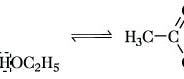
© public domain (Ausschnitt)
Vielleicht zwei von drei spektrumdirekt-Lesern sind Naturwissenschaftler, und fast alle waren – oder werden – irgendwann einmal ungewollt mit drei Dingen konfrontiert: Chemieprüfungen, dafür auswendig gelernte alte Chemie-Prüfungsfragen und Chemieprüfern, die einen in ersteren viel zu selten zweites auch wirklich fragen. Gut dran war dann, wer während des Lernens irgendwann doch einmal verstanden hatte, warum welche Moleküle was auch immer miteinander machen – um so mangelnde Ahnung erfolgreich zu vertuschen. Nur eines ist wohl keinem gezwungenem Nebenfachchemiker jemals so wirklich klar geworden: Die Sache mit den Katalysatoren.
Über Katalysatoren mussten eigentlich nur drei Dinge auswendig hergeleiert werden, um die Prüfung nicht ganz zu verhauen: Sie beschleunigen eine Reaktion, ohne ihren Ausgang zu ändern. Sie sind oft aus einem exotischen Edelmetall, nehmen wir Palladium oder Platin. Und dann nur noch etwas Schlaues wie "Grenzflächenreaktion" murmeln, das reicht. Tiefer hat ein Prüfer eigentlich nie gefragt.
Mit gutem Grund: Bis heute können selbst viele der interessiertesten Chemie-Experten gar nicht ganz genau erklären, warum Katalysatoren das tun, was sie tun. Ingenieure schreckte das zwar noch nie ab: Sie lernen durch Handeln und setzten seit langer Zeit allerlei Werkstoffe ein, die als Kat gute Dienste zur Beschleunigung wichtiger chemischer Produktionsprozesse leisten, auch den Grund zu kennen. Man schätzt, dass rund achtzig Prozent aller modernen Chemikalien im Laufe ihrer Herstellung mit zumindest einem Katalysator in Berührung kommen. Trotzdem: Vielleicht ginge mancher Produktionszyklus noch glatter, wenn man wüsste, wie die Reaktionsbeschleuniger genau arbeiten? Vielleicht könnten mit diesem Wissen Reaktionsbeschleuniger für bestimmte Aufgaben gezielt ausgesucht oder gar produziert werden – Stichwort "rationales Katalysator-Design"?
Chemiker arbeiten an zwei Fronten, um die Geheimnisse der Katalyse weiter zu entschlüsseln: Anorganiker analysieren Aufbau und Oxidationsstufen der Metallatome in Katalysator-Oberflächen und versuchen, deren geometrische Ausrichtung zu analysieren. Sie arbeiten dazu etwa mit Absorptionspektroskopie und paramagnetischer Elektronenspinresonanz. Vereinfacht gesagt finden die Wissenschaftler so heraus, welche Montagekräne und Werkzeuge der Katalysator überhaupt in Richtung der hereinstrudelnden, umzubauenden Moleküle streckt.
Mit anderer Stoßrichtung nähern sich Organo-Chemiker dem Problem: Sie untersuchen das bei der katalysierten Reaktion umgesetzte Molekül selbst und versuchen Zwischenstadien und Reaktionsmechanismen des Umbauprozesses aufzudecken. Bislang halfen ihnen dabei etwa NMR-, Infrarot- oder Raman-Spektroskopie. Oft schaffen diese Untersuchungsmethoden aber ein Problem: Um zu funktionieren, analysieren sie die Reaktion nihct bei Raumtemperatur, normalem Druck oder in Flüssigkeit gelöst sondern unter Bedingungen, die nicht sehr realistisch sind – zum Beispiel im Vakuum.
Nun aber fand Maarten Roeffaerts und sein Team von der Katholischen Universität Leuven in Belgien einen neuen Ansatz, um mit eigenen Augen unter natürlichen Bedingungen und zeitnah sehen zu können, was bei einer katalysierten Reaktion genau geschieht. Die Chemiker beobachteten dazu im wässrigen Milieu eine einfache chemische Reaktion – den Umbau einer Esterbindung – an Kristallen eines aus doppelt hydroxylierten Aluminium- und Lithium-Ionen bestehenden Katalysators, der aus mehreren flachen, übereinander parallel geschichteten Platten aufgebaut war.
Besonderer Clou ihrer Arbeit war aber der Einsatz einer Fluoreszenzmarkierung der umgesetzten Moleküle: In dem Augenblick, in dem sich die Esterbindung löste, wurde der Farbstoff frei und durch ein Fluoreszenzmikroskop an punktgenau der Stelle des Katalysator sichtbar, der entscheidend an der Umsetzung beteiligt war.
Besonders ins Auge sprang den Forschern bei den ersten Untersuchungen, wie ortsspezifisch verschiedene Reaktionen unter geeigneten Bedingungen auch stets an verschiedenen, offenbar spezialisierten Regionen des flächigen, lamelligen Katalysator-Sandwiches abliefen. Etwa die hydrolytische Auflösung einer Esterbindung: Sie erfolgte stets an den Seiten des Katalysators. Ganz anders die – chemisch gesehen gar nicht so furchtbar andere – Umesterung, bei der das Molekül einen per Esterbindung angehängten Substituenten mit einem anderen tauscht: Sie erfolgte nicht nur an den Seiten, sondern fast immer auf der gesamten flächigen Oberseite des Kats.
Damit könnten Ingenieure schon etwas anfangen, wollten sie einen Katalysator für eine bestimmte Umesterungsreaktion formen. Theoretische Chemiker freuen sich, weil ihnen das Ergebnis bestätigt, dass die Ester-Hydrolyse eine so genannte struktursensitiv katalysierte Reaktion ist – die Transesterifikation aber nicht. Und Bert Weckenhuysen von der Universität Utrecht denkt schon an morgen und freut sich über Dinge, die mit der Fluoreszenz-Spektroskopie als ergänzende Methode in Zukunft herausgefunden werden dürften: Zeitnahe Schnappschüsse von an ganz unterschiedlichen Dingen arbeitenden Katalysatoren, so der Chemiker, könnte dem gezielten Design der Reaktionsbeschleuniger schon bald einen neuen Schub geben.
Über Katalysatoren mussten eigentlich nur drei Dinge auswendig hergeleiert werden, um die Prüfung nicht ganz zu verhauen: Sie beschleunigen eine Reaktion, ohne ihren Ausgang zu ändern. Sie sind oft aus einem exotischen Edelmetall, nehmen wir Palladium oder Platin. Und dann nur noch etwas Schlaues wie "Grenzflächenreaktion" murmeln, das reicht. Tiefer hat ein Prüfer eigentlich nie gefragt.
Mit gutem Grund: Bis heute können selbst viele der interessiertesten Chemie-Experten gar nicht ganz genau erklären, warum Katalysatoren das tun, was sie tun. Ingenieure schreckte das zwar noch nie ab: Sie lernen durch Handeln und setzten seit langer Zeit allerlei Werkstoffe ein, die als Kat gute Dienste zur Beschleunigung wichtiger chemischer Produktionsprozesse leisten, auch den Grund zu kennen. Man schätzt, dass rund achtzig Prozent aller modernen Chemikalien im Laufe ihrer Herstellung mit zumindest einem Katalysator in Berührung kommen. Trotzdem: Vielleicht ginge mancher Produktionszyklus noch glatter, wenn man wüsste, wie die Reaktionsbeschleuniger genau arbeiten? Vielleicht könnten mit diesem Wissen Reaktionsbeschleuniger für bestimmte Aufgaben gezielt ausgesucht oder gar produziert werden – Stichwort "rationales Katalysator-Design"?
Chemiker arbeiten an zwei Fronten, um die Geheimnisse der Katalyse weiter zu entschlüsseln: Anorganiker analysieren Aufbau und Oxidationsstufen der Metallatome in Katalysator-Oberflächen und versuchen, deren geometrische Ausrichtung zu analysieren. Sie arbeiten dazu etwa mit Absorptionspektroskopie und paramagnetischer Elektronenspinresonanz. Vereinfacht gesagt finden die Wissenschaftler so heraus, welche Montagekräne und Werkzeuge der Katalysator überhaupt in Richtung der hereinstrudelnden, umzubauenden Moleküle streckt.
Mit anderer Stoßrichtung nähern sich Organo-Chemiker dem Problem: Sie untersuchen das bei der katalysierten Reaktion umgesetzte Molekül selbst und versuchen Zwischenstadien und Reaktionsmechanismen des Umbauprozesses aufzudecken. Bislang halfen ihnen dabei etwa NMR-, Infrarot- oder Raman-Spektroskopie. Oft schaffen diese Untersuchungsmethoden aber ein Problem: Um zu funktionieren, analysieren sie die Reaktion nihct bei Raumtemperatur, normalem Druck oder in Flüssigkeit gelöst sondern unter Bedingungen, die nicht sehr realistisch sind – zum Beispiel im Vakuum.
Nun aber fand Maarten Roeffaerts und sein Team von der Katholischen Universität Leuven in Belgien einen neuen Ansatz, um mit eigenen Augen unter natürlichen Bedingungen und zeitnah sehen zu können, was bei einer katalysierten Reaktion genau geschieht. Die Chemiker beobachteten dazu im wässrigen Milieu eine einfache chemische Reaktion – den Umbau einer Esterbindung – an Kristallen eines aus doppelt hydroxylierten Aluminium- und Lithium-Ionen bestehenden Katalysators, der aus mehreren flachen, übereinander parallel geschichteten Platten aufgebaut war.
Besonderer Clou ihrer Arbeit war aber der Einsatz einer Fluoreszenzmarkierung der umgesetzten Moleküle: In dem Augenblick, in dem sich die Esterbindung löste, wurde der Farbstoff frei und durch ein Fluoreszenzmikroskop an punktgenau der Stelle des Katalysator sichtbar, der entscheidend an der Umsetzung beteiligt war.
Besonders ins Auge sprang den Forschern bei den ersten Untersuchungen, wie ortsspezifisch verschiedene Reaktionen unter geeigneten Bedingungen auch stets an verschiedenen, offenbar spezialisierten Regionen des flächigen, lamelligen Katalysator-Sandwiches abliefen. Etwa die hydrolytische Auflösung einer Esterbindung: Sie erfolgte stets an den Seiten des Katalysators. Ganz anders die – chemisch gesehen gar nicht so furchtbar andere – Umesterung, bei der das Molekül einen per Esterbindung angehängten Substituenten mit einem anderen tauscht: Sie erfolgte nicht nur an den Seiten, sondern fast immer auf der gesamten flächigen Oberseite des Kats.
Damit könnten Ingenieure schon etwas anfangen, wollten sie einen Katalysator für eine bestimmte Umesterungsreaktion formen. Theoretische Chemiker freuen sich, weil ihnen das Ergebnis bestätigt, dass die Ester-Hydrolyse eine so genannte struktursensitiv katalysierte Reaktion ist – die Transesterifikation aber nicht. Und Bert Weckenhuysen von der Universität Utrecht denkt schon an morgen und freut sich über Dinge, die mit der Fluoreszenz-Spektroskopie als ergänzende Methode in Zukunft herausgefunden werden dürften: Zeitnahe Schnappschüsse von an ganz unterschiedlichen Dingen arbeitenden Katalysatoren, so der Chemiker, könnte dem gezielten Design der Reaktionsbeschleuniger schon bald einen neuen Schub geben.

Schreiben Sie uns!