Epigenetik: Die Dunkle Materie des Erbguts
Gene, Transkriptionsfaktoren, epigenetische Schalter: Vor den Funktionsprozessen des Erbguts stehen Biologen zunehmend ehrfürchtig. Denn immer wenn sie ein kompliziertes genetisches Regelwerk entschlüsselt haben, lernen sie anschließend noch komplexere, übergeordnete Mechanismen kennen, die dieses Regelwerk umsetzen, verändern und kontrollieren. Dabei kommen immer wieder auch ganz neue Moleküle ins Blickfeld – zuletzt etwa das neueste Mitglied der vielfältigen zellulären RNA-Familie namens "lange nichtkodierende RNA", kurz lncRNA. Die ist nicht einfach eine weitere RNA – sie funktioniert anders als ihre kurzen Verwandten, wie sich nach und nach herausschält.
LncRNAs sind erst lange völlig übersehen und dann dramatisch unterschätzt worden. Die definitionsgemäß über 100 Kettenglieder langen Nukleinsäureschnipsel sind insgesamt kurzlebig, dafür aber enorm vielfältig und sehr, sehr häufig: Sie machen tatsächlich den Löwenanteil aller Transkripte des Genoms aus – jener Arbeitskopien also, die der Zellapparat aus DNA-Vorlagen fertigt. Nur rund ein Prozent der DNA eines Durchschnittssäugetiers wird bei diesem Prozess zu einer Boten- oder mRNA, dem bekanntesten Transkript-Typ, in dem der Bauplan für ein Protein niedergelegt ist. Etwa 70 bis 90 Prozent der gesamten DNA – früher bezeichnete man diesen "Rest" als überflüssige "Junk-DNA" – dienen nie als Proteinvorlage, werden durchaus aber zu irgendeinem Zeitpunkt in RNA transkribiert. Es entstehen dabei neben verschiedenen regulierenden, eher kurzen RNA-Sorten wohl auch 10 000 bis vielleicht 200 000 lncRNA-Ketten – die genaue Zahl kann bisher nur sehr grob geschätzt werden. Die "Dunkle Materie" des Genoms, wie die RNA-Expertin Jeannie Lee von der Harvard Medical School die lncRNAs nennt.
Lang statt kurz – und sonst?
Lee und ihr Fachkollegen zweifeln längst nicht mehr daran, dass diese dunkle Materie im Zellgeschehen nützlich ist. Sollte die hochgegriffenen Schätzungen stimmen, so würde jedes einzelne Gen des Menschen von etwa zehn unterschiedlichen lncRNA-Sequenzvarianten flankiert – Sequenzen, die die klassischen Gene oder ihre Regulatoren, etwa Promotoren und Enhancer, teilweise überlappen. Zu welchem Zweck treiben Zellen diesen Aufwand? Sicher entstehen einige der hier kodierten lncRNAs schlicht im Tagesgeschäft der Zelle nebenbei. Vielleicht als Abfallprodukt der Maschinerie, einer Art transkriptomischen Hintergrundrauschens, die von der neuen präziseren Analysemethodik erfasst wird?
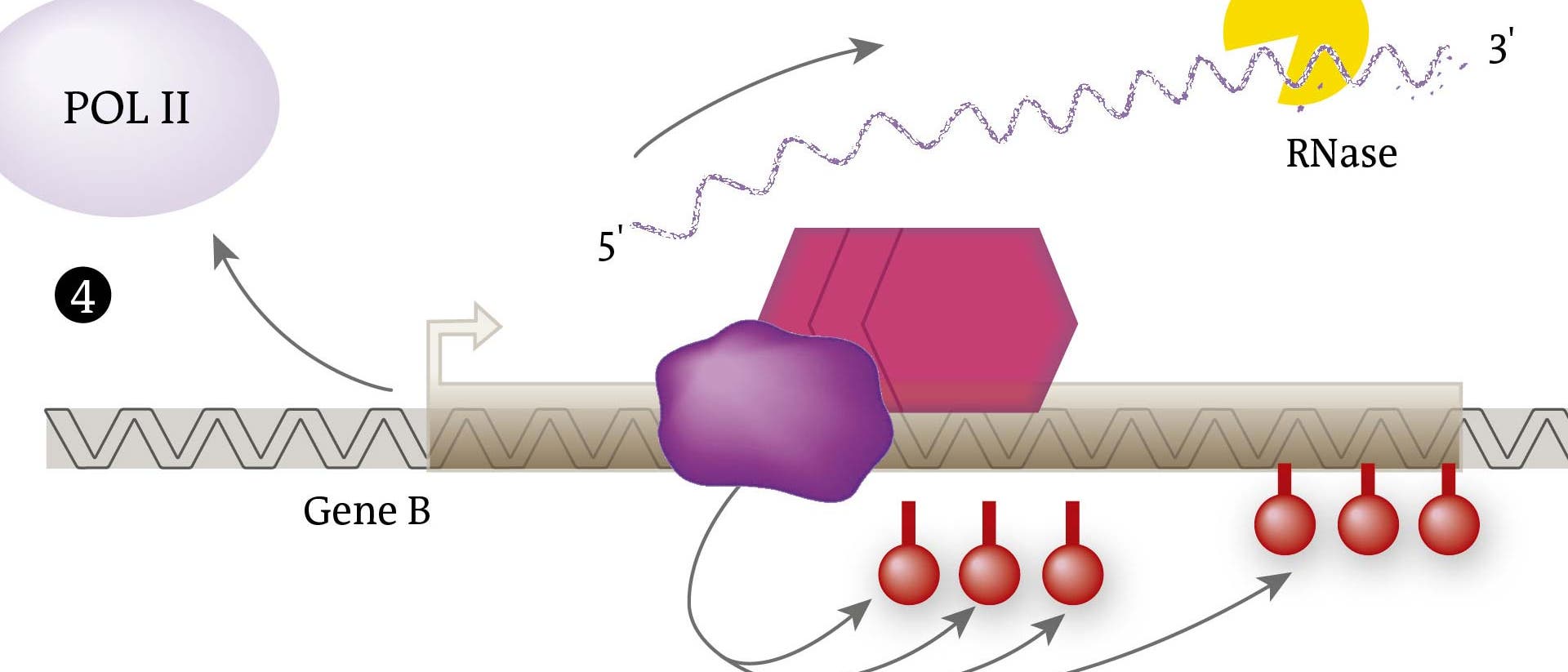
Viele lncRNAs aber, vielleicht die meisten, dürften allerdings auch Funktionen übernehmen. Nachweisen konnten Forscher etwa schon eine besondere Bedeutung von verschiedenen langen RNAs bei der "genomischen Prägung", also dem epigenetisch geregelten Prozess, der dafür sorgt, dass von der mütterlichen und väterlichen Kopie eines Gens im Erbguts bevorzugt nur eine abgelesen wird. Ein drastischer Spezialfall dieser asymmetrischen Genregulation ist der Mechanismus, mit dem weibliche Zellen gleich alle Gene auf einem der beiden X-Chromosomen ausknipsen: Hier übernehmen lncRNAs verschiedene Aufgaben am genetischen Hauptschalter des Geschehens, dem "X-inactivation center", kurz Xic. Dieses regulatorische Zentrum befindet sich am inaktivierten X-Chromosom: Er besorgt das epigenetische Ausschalten des gesamten Chromosoms. Als Exekutive fungiert dabei der Enzymkomplex PRC2, der die epigenetischen Schalter setzt. Nötig ist dafür aber eben auch eine lncRNA namens "Xist": Sie erst weist dem PRC2-Enzym den Weg zur Xic-Andockstelle. Und zwei weitere lncRNAs regulieren wiederum Xist und machen das System so flexibel wie nötig.
Ein ganz typischer Prozess, meinten Forscher in ihrer Arbeitshypothese zur Wirkungsweise von lncRNA: Der genetische Hauptschalter (Xic) – eine regulative Andockregion im Erbgut, in der kein Proteinbauplan kodiert ist – wird von verschiedenen ebenso nicht kodierenden RNAs umschwirrt, die ihn bedienen. Das ähnelt allerdings im Wesentlichen der Arbeitsweise der schon seit Längerem bekannten RNA-Transkriptionsfaktoren. Wie unterscheiden sich lncRNAs von den kürzeren, länger bekannten Varianten?
Vor allem durch ihre stark begrenzte Lebensdauer: Typischerweise beginnen die langen RNAs schon wieder an einem Ende zu zerfallen, während das andere noch produziert wird. lncRNAs diffundieren daher auch kaum in wesentlichen Mengen zu fernen Regulationsorten: Ihre Wirkung beschränkt sich auf die unmittelbare Nachbarschaft. Das prädestiniert sie zum Beispiel dazu, nur genau ein "Allel", also eine von zwei Genkopien, auszuschalten, eben die lokale beziehungsweise nächstgelegene. Sie wirken damit also "allelspezifisch", am Ort ihrer Produktion. Regulationsproteine können das zum Beispiel nicht: Ihre Boten-RNA-Blaupause wird zur Produktion – also der Translation am Ribosom, der Eiweißfabrik der Zelle – erst aus dem Zellkern herauskomplimentiert. Ein Gedächtnis für ihren genauen Geburtsort im Zellkern oder gar die Genkopie, die sie kodiert hat, haben sie nicht.
Anketten an Ort und Stelle
Neben der in ihrer Kurzlebigkeit und damit geringen Reichweite liegenden Allelspezifität sind lncRNAs aber womöglich auch extrem genaue Wegweiser für allerlei Spezialenzyme, die nur an einem ganz bestimmten Genort andocken sollen. Der Grund ist simpel: Die langen RNAs sind länger; sie können somit mehr und spezifischere Informationen enthalten und solchen Spezial-Regulationsproteinen als exakteres Signal dienen. Auch hierbei wirken lncRNAs wie die oben beschriebene Xist-RNA streng lokal: Noch während sie gebildet wird, dockt das zuständige PRC2-Enzym an die spezifische Bindestelle in der lncRNA an, wird damit auch an den Genort angekettet und beginnt genau hier mit seiner Aufgabe, in diesem Fall der epigenetischen Markierung.
Bei allen Gemeinsamkeiten der lncRN-Typen – die Unterschiede zwischen ihnen sind sicherlich noch zahlreicher. Das zeigen schon die verschiedenen provisorischen Klassifizierungsysteme und die vielen neu erfundenen Namen für ihre Vertreter: Man unterscheidet PASR ("promotor-associated short RNA"), NAT ("natural antisense-transcripts"), lincRNA ("large intervening noncoding RNA") oder eRNA ("enhancer-associated RNA"), die alle auf die eine oder andere Art unterschiedliche Dinge auf unterschiedlichen Wegen erledigen.
Dabei gibt es offenbar wenig, was nicht geht: So stellt ein vielköpfiges Forscherteam um Denise Barlow vom Wiener Zentrum für Molekulare Medizin (CeMM) zum Beispiel gerade eine lncRNA vor, die gar nicht fertig gebaut werden muss, um zu funktionieren.
Wildwestlandschaft RNA
Die Wissenschaftler beschäftigten sich in Mäusen und Zellkulturen mit einer lncRNA namens "Airn", die nach allem, was zuvor bekannt war, eine typische Regulatorfunktion im Zuge genomischer Prägung innehat: Sie schaltet im Erbgut gezielt nur die vom Vater stammende Kopie des Gens lgf2r aus. Allerdings scheint dafür eben nicht der für Xic, Xist und PRC2 vorgestellte typische Mechanismus angekurbelt zu werden, bei dem die RNA ein Enzym rekrutiert und dann epigenetische Aus-Schalter an das Gen heften lässt. Tatsächlich scheint nicht einmal die lncRNA selbst notwendig zu sein, wie die Forscher bei Experimenten herausfanden, in denen sie die lncRNA-Produktion manipulierten – lgf2r blieb jedoch trotzdem gehemmt [1].
Wichtig, so schlussfolgern die Forscher nach weiteren Experimenten, ist stattdessen allein der Transkriptionsprozess, nicht aber dessen Resultat, die lncRNA Airn: Der Beginn der Transkription von Airn, mithin schon das Andocken des für den Bau der RNA zuständigen Enzyms, behindert offenbar das Ablesen des lgf2r-Gens, weil das Enzym den lgf2r-Promoter, also dessen wesentliche Andockstelle, blockiert. Blockadeinstrument ist demnach das Überlappen der Promotoren von Gen und RNA.
So oder so ähnlich könnten durchaus noch viele andere lncRNAs arbeiten, vermuten die Forscher um Barlow nun. Und tatsächlich passen einige typische Eigenschaften der "Dunklen Zellmaterie" zu dem nun postulierten Mechanismus: lncRNAs sind sehr kurzlebig (weil sie gar nicht als Molekül wirken, sondern durch ihre Produktion), sie sind sehr variabel (denn auf ihre genaue Sequenz kommt es in diesem Fall nicht an), und sie werden typischerweise sehr schnell in großen Massen produziert (schließlich hemmt der Produktionsprozess, nicht das Produkt das zu regulierende Gen).
Andere lncRNAs, so viel ist sicher, wirken aber wieder anders. Und selbst die "Blockade-lncRNA" Airn selbst hat noch andere Tricks auf Lager: Das für die Hemmung des lgf2r-Gens wohl überflüssige Transkript hemmt – unter bestimmten Umständen – zusätzlich zwei andere Gene. Selbst für RNA-Experten wie Jeannie Lee wird es nun langsam schwierig, den Überblick zu behalten: ein Durcheinander von molekularen Mechanismen und Systemvielfalt "wie im wilden Westen", so die Forscherin in einem Übersichtsartikel [2]. Es dürfte noch einige Jahre dauern, bis auf diesem Feld keine Überraschungen mehr zu erwarten sind.

Schreiben Sie uns!
Beitrag schreiben