Medizintechnik: Elektrischer Anschluss ans Nervensystem
Es ist eine der berühmtesten Sciencefiction-Filmszenen: Luke Skywalker begutachtet seinen neuen künstlichen Unterarm samt Hand. Durch eine geöffnete Klappe am Handgelenk sieht der Held aus "Star Wars", wie sich Kolben vor- und zurückbewegen und dadurch seine Finger krümmen oder strecken. Später spürt er deutlich, wie der Roboterchirurg ihm in den Finger sticht. Er kann die Prothese also nicht nur durch seine Gedanken bewegen, sie fühlt sich für ihn auch wie seine eigene Hand an.
Was das Publikum allerdings nicht sieht, sind die Details der Verbindung zwischen Mensch und Maschine. Aber gerade die wären das Spannendste an der ganzen Szene gewesen – zumindest für uns Neurowissenschaftler. Damit solch eine Verknüpfung funktioniert, müssen Nervenimpulse aus dem Gehirn in elektrische Signale im künstlichen Arm umgewandelt werden und umgekehrt. Und das ist außerhalb der Fantasiewelt der Filme noch niemandem gelungen.
Das ist auch wenig überraschend. Zum einen übertragen sowohl Nerven als auch Stromleitungen ihre Signale zwar mit Hilfe elektrischer Ladungen, aber auf völlig verschiedene Art. Im Draht fließen Elektronen, während sich entlang der Nervenfaser eine elektrische Depolarisierung der Zellmembran fortpflanzt und Informationen von einer Nervenfaser zur anderen durch Ausschüttung chemischer Signalmoleküle gelangen. Zum anderen müsste für eine solche Verknüpfung der Nerv zu irgendeinem elektrisch leitfähigen Material in engem Kontakt stehen. Dieses aber würde das Immunsystem als Fremdkörper erkennen und entsprechend heftig bekämpfen, wodurch sich Narbengewebe um die Kontaktstelle bilden und ihre Funktionsfähigkeit zerstören würde.
In den letzten Jahren sind die Forscher mit Hilfe der Nanotechnologie und der Technik der Gewebezüchtung ("Tissue Engineering") der Lösung beider Probleme nähergekommen. Sie versuchen nicht, die Nerven zu direkter Kommunikation mit einem üblichen elektrischen Anschluss zu zwingen; stattdessen bauen wir – und andere Wissenschaftler – neue Arten von Brücken zwischen Nerven und künstlichen Gliedern. Dabei nutzen wir die natürliche Fähigkeit des Nervensystems, sich neuen Umgebungen anzupassen. Noch liegt Luke Skywalkers Kunstarm samt Bewegungs- und Empfindungsfähigkeit außerhalb unserer Reichweite; aber unsere jüngsten Forschungsergebnisse haben uns auf dem Weg zu diesem Ziel ein gutes Stück weitergebracht.
Die Entwicklung künstlicher Gliedmaßen hat in den letzten Jahren einen großen Aufschwung genommen, auch wenn man über dessen Ursache nicht wirklich glücklich sein kann: Bewaffnete Konflikte, namentlich die Kriege in Afghanistan und im Irak, haben einen großen Bedarf geschaffen. Nachdem 2006 die Wissenschaftsagentur des amerikanischen Verteidigungsministeriums (DARPA) das ambitionierte Programm "Revolutionizing Prosthetics" ins Leben rief, haben die Forscher beeindruckende Fortschritte erzielt.
Bis vor wenigen Jahren konzentrierten sich die Prothesenkonstrukteure auf die untere Körperhälfte. Ein künstliches Bein, mit dem man im Wesentlichen nur gehen und stehen muss, ist einfacher zu konstruieren als eine Hand, die ein Einmachglas aufdrehen oder auf einer Computertastatur tippen soll. Die hochentwickelte Feinmotorik der menschlichen Hand auch nur teilweise nachzubilden, ist die größte Herausforderung an die Kunst des Prothesenbaus.
Das Gehirn sendet Nervensignale an eine Vielzahl von Muskeln im Unterarm und in der Hand selbst; zugleich empfängt es über andere Nervenfasern Rückmeldungen über Druck, Position, Spannung, Impuls und Kraft und nutzt sie, um die Aktivität der Muskeln präzise zu dosieren. Dazu verfügt das Gehirn über spezielle Areale, in denen diese Region des Körpers repräsentiert ist. Auf diese "mentalen Karten" müsste eine elektronisch betriebene Prothese zugreifen.
Bei einer gesunden Hand arbeiten motorische und sensorische Signale zusammen und verschaffen uns unter anderem die Eigenwahrnehmung ("Propriozeption"): Wir wissen, wo sich unsere Körperteile im Raum befinden und wie sie zueinander stehen, ohne nachsehen zu müssen. Ohne Propriozeption könnten wir nicht einmal mit einem Bleistift umgehen. Erst durch das präzise Zusammenspiel aus- und eingehender Nervenimpulse können wir unsere Hand ganz genau auf den Stift zubewegen, ihn vorsichtig anheben, in einer harmonischen Bewegung greifen und mit genau dosiertem Druck aufs Papier setzen.
Wie kann man Nervenimpulse aufzeichnen, ohne dem Menschen einen Draht in den Kopf zu stecken?
Bisher konstruierte Roboterhände empfangen die Signale zu ihrer Bewegungssteuerung auf verschiedene, meist indirekte Weise. Beispielsweise betätigt der Träger der Prothese durch wiederholtes Anspannen und Entspannen von Muskeln in der Brust oder im Armstumpf spezielle Schalter, die dann verschiedene Bewegungen der Prothese auslösen. Besser wäre es allerdings, die Prothese wäre mit den ursprünglichen motorischen Nerven verbunden und würde durch sie gesteuert. Diese Nerven sterben nach der Amputation nicht etwa ab, sondern ziehen sich nur ein Stück vom Stumpfende zurück.
Selbst mit den inzwischen sehr fortgeschrittenen Prothesen erweisen sich jedoch die einfachsten Aufgaben als überaus schwierig, da die sensorische Rückkopplung fehlt. Ein Amputierter kann nicht auf das natürliche Gefühl der Propriozeption zurückgreifen, sondern muss jede kleinste Bewegung seiner Prothese im Auge behalten und ganz bewusst kontrollieren. Das gelingt ihm nur sehr langsam und unbeholfen. Da fordert bereits das Zuknöpfen des Hemdes seine Konzentration bis zur Erschöpfung.
Es kommt demnach entscheidend darauf an, dass die Anschlussstelle (das "Interface") zwischen Nervensystem und Prothese in beiden Richtungen funktioniert, also einen Austausch von motorischen wie sensorischen Informationen erlaubt. Eine solche Handprothese wäre nicht nur intuitiv, durch die reine Kraft der Gedanken, ansteuerbar, sondern würde sich auch "echt anfühlen". Etliche Forschungseinrichtungen, darunter unsere, verfolgen nun dieses ehrgeizige Ziel mit unterschiedlichen Ansätzen, die ihre je eigenen Vor- und Nachteile haben. Vermutlich wird am Ende ein erfolgreiches Produkt von jedem etwas aufgreifen – und zusätzlich technologische Innovationen erfordern.
Die erste Grundsatzentscheidung betrifft die Position der Anschlussstelle innerhalb des Nervensystems. Es stehen im Wesentlichen zwei Möglichkeiten zur Auswahl: das zentrale Nervensystem aus Gehirn und Rückenmark oder das periphere Nervensystem, genauer gesagt, jener Nerv, der vom Rückenmark ausgeht und zu gesunden Zeiten die zu ersetzende Hand versorgte.
Bislang wählen die meisten Wissenschaftler das Gehirn als Signalquelle. In einem der Projekte wird dessen Aktivität durch Elektroden aufgezeichnet, die an der Kopfhaut oder direkt unter der Schädeldecke auf der Hirnoberfläche selbst angebracht sind. Ein Computer analysiert die Signale und setzt sie in die gewünschten Bewegungsbefehle um. Diese Methoden haben den Vorteil, dass sie nicht in das Gehirn selbst eingreifen. Jedoch wird das aufgenommene Signal häufig durch elektrische Geräte in der Umgebung gestört und gibt obendrein die Gehirnaktivität nur sehr grob wieder. Entsprechend schwierig ist es für das Analyseprogramm zu ermitteln, welche Bewegung beabsichtigt ist.
Bei der invasivsten Technik dagegen werden Reihen von Mikroelektroden direkt in die Hirnrinde implantiert. Es handelt sich typischerweise um Sonden aus Silizium hoher Dichte, jede dünner als ein menschliches Haar. Ein solch direkter Anschluss bietet den gewaltigen Vorteil, dass er sehr genaue und reichhaltige Daten liefert, bis hin zur Aktivität einzelner Nervenzellen. Entsprechend präzise könnte die Prothese angesteuert werden.
Anschlüsse ans Gehirn – mehr oder weniger invasiv – werden bereits an Dutzenden von Menschen getestet. Eine Frau, die durch einen Schlaganfall gelähmt war, lernte, nur mit Hilfe ihrer Gedanken ihren Roboterarm so präzise zu führen, dass sie Kaffee aus einem Becher trinken konnte. Im vergangenen Jahr startete DARPA ein Projekt, bei dem erstmalig einigen Personen, die ihre Arme verloren haben, Elektroden ins Gehirn implantiert werden sollen, um mit ihnen hochmoderne Prothesen zu steuern. In beiden Fällen sind die Elektroden, welche die neuronalen Signale aufzeichnen, mit Drähten verbunden, die aus der Schädeldecke herauskommen. Ein leistungsstarker Computer analysiert die eingehenden Signale und verwandelt sie in Befehle an den Roboterarm. Letztendlich hoffen Wissenschaftler, die Informationen drahtlos übertragen zu können, damit ein Patient nicht mit dem Computer verkabelt sein muss, um seine Armprothese bewegen zu können. Noch besser wäre ein kleiner Computer, den man am Körper oder sogar unter der Haut tragen kann – aber leider reicht dafür die Leistung der derzeit verfügbaren Geräte noch nicht aus.
Ein weiterer Nachteil ist, dass das Hirngewebe die eindringenden Elektroden als Fremdkörper bekämpft und mit einer Entzündung reagiert, die schließlich zur Bildung von Narbengewebe führt. Dadurch wird die Elektrode gewissermaßen betäubt: Die empfangenen Signale werden schwächer, und die Zahl der überhaupt abhörbaren Nervenzellen nimmt mit der Zeit exponentiell ab. Bei einigen Patienten haben die Elektroden Berichten zufolge noch mehrere Jahre nach der Implantation Signale von einem oder mehreren Neuronen übermittelt, aber diese Fälle sind die Ausnahme. Forscher suchen nun nach Wegen, um die körpereigene starke Immunreaktion gegen Fremdobjekte im Gehirn zu minimieren.
Angesichts dieser erheblichen Schwierigkeiten zogen wir es vor, das periphere Nervensystem anzuzapfen. Im Gegensatz zum zentralen Nervensystem, das sich aus bis zu 100 Milliarden Nervenzellen zusammensetzt, hat man es hier hauptsächlich mit einzelnen Fasern zu tun, den Axonen, die zu Nerven gebündelt sind. Axone sind bis zu einem Meter lange Fortsätze von Nervenzellen, die elektrische Signale übertragen.
Manche peripheren Nervenfasern verlaufen vom Rückenmark zu den Muskeln; mit ihrer Hilfe steuert das Gehirn – auf dem Weg über das Rückenmark – unsere Bewegungen. Andere übertragen Wahrnehmungen wie räumliche Position eines Körperteils, Temperatur oder Berührung von dort zum Rückenmark, das sie an das Gehirn weiterleitet.
Da abgeschnittene sensorische Nerven nach einer Amputation oft weiterhin Signale abgeben, haben viele Amputierte die Empfindung, ihre fehlende Extremität sei noch da – der Phantomschmerz. Wenn man diese fehlfeuernden sensorischen Axone an eine Prothese anschließen könnte, die starke Signale abgibt, würde das Gehirn diese bereitwillig als von einem Unterarm, einer Hand oder einem Finger stammend interpretieren.
Ebenso sind die motorischen Axone des peripheren Nervensystems noch fähig, Bewegungen zu steuern. Da das Gehirn diese verschiedenen motorischen Signale zu geordneten Bewegungen zusammensetzen kann, würde es eine korrekt angeschlossene Prothese auf natürliche Weise bewegen.
Ein abgeschnittenes peripheres Axon kann sogar wieder wachsen, allerdings nur dann, wenn es eine Zielstruktur gibt, zu der es Kontakt herzustellen vermag. Ein metallischer Draht könnte jedoch diese Rolle nicht übernehmen, ganz abgesehen davon, dass ihn das Immunsystem ebenso attackieren würde wie eine ins Gehirn implantierte Elektrode.
Todd Kuiken von der Northwestern University in Chicago und seine Arbeitsgruppe haben eine raffinierte Umgehung dieses Problems erfolgreich an Freiwilligen getestet: Sie nutzen Brustmuskeln als "lebende Brücken" zwischen dem Armstumpf und dem elektrischen Anschluss einer Prothese. Zunächst kappen die Wissenschaftler die motorischen Nerven zu einigen oberflächliche Brustmuskeln, damit diese keine konkurrierenden Signale vom Gehirn mehr empfangen können. Dann leiten sie die motorischen Axone, die ursprünglich vom Rückenmark zu dem nun abgetrennten Teil des Arms verliefen, sorgfältig um, so dass sie nun stattdessen die zuvor präparierten Brustmuskeln innervieren – ein Wachstumsprozess, der binnen weniger Wochen abgeschlossen ist. Befehle vom Gehirn, die eigentlich an die Muskeln des nicht mehr vorhandenen Arms gerichtet sind, wandern nun zur Brust und veranlassen dort Muskeln zur Kontraktion.
Dort setzen die Forscher Elektroden auf die Haut auf. Die registrieren die elektrische Aktivität einzelner Muskeln und damit indirekt die Signale, die vom Gehirn kommen. Nach einigen Wochen Training kann der Patient seine Prothese "mit Gedankenkraft" bewegen. Indem er zum Beispiel daran denkt, einen Becher zu greifen, löst er ein spezielles Muster von Muskelzuckungen in seiner Brust aus. Die ihrerseits weisen – auf dem Weg über die dort aufgesetzten Elektroden – die Elektronik in der Prothese an, die Finger der künstlichen Hand zu krümmen. Kuiken und seine Gruppe haben diese "zielorientierte Muskel-Reinnervierung" (targeted muscle reinnervation, TMR) inzwischen bei Dutzenden von Amputierten angewandt. Ob man damit allerdings die Feinmotorik einer echten Hand erreichen kann, bleibt abzuwarten.
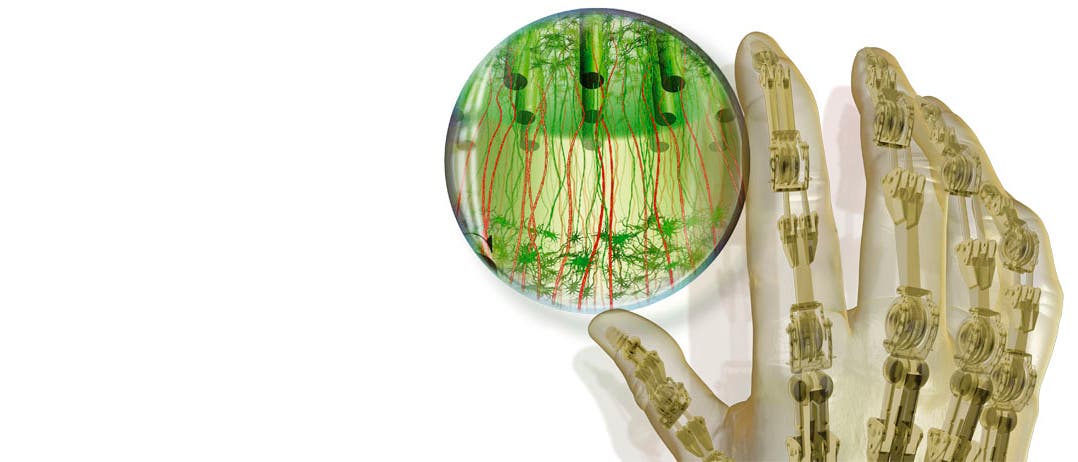
Wir glauben, dass dieses ambitionierte Ziel letztendlich eine andere Form von Verknüpfung zwischen lebendem Gewebe und Prothese erfordert. Glücklicherweise ist ein abgeschnittener Nerv nicht auf einen Muskel als Zielstruktur für sein Wachstum beschränkt. Er wächst auch in Richtung anderer Nerven und akzeptiert diese selbst dann, wenn sie transplantiert sind. Diese Möglichkeit beschlossen wir vor ungefähr sechs Jahren auszuloten: An Stelle von Muskeln sollten transplantierte Nervenfasern als Vermittler zwischen den durchtrennten Axonen in einem Stumpf und der elektrischen Steuerung einer Prothese dienen.
Um eine solche neuronale Brücke zu schaffen, muss man zunächst Nervenfasern in Zellkultur dazu bringen, in die Länge zu wachsen. Einer von uns (Smith) hat dafür eine Technik namens "stretch-grow" entwickelt, welche die natürliche Fähigkeit von Nerven nutzt, mit dem umgebenden Gewebe mitzuwachsen. Der Extremfall sind die Rückenmarksaxone des Blauwals, die bis zu drei Zentimeter pro Tag zulegen und insgesamt bis zu 30 Meter lang werden können.
Im Wesentlichen bringen wir eine Kultur von Nervenzellen auf zwei Träger auf, die wir dann ganz allmählich auseinanderziehen. Axone, die ursprünglich auf beiden Trägern lagen, geraten dadurch unter Spannung; dieser Reiz veranlasst sie dazu, in beide Richtungen zu wachsen. In den von uns entwickelten speziellen Geräten, den "axon elongators"("Axonstrecker"), bringen es die Axonbündel auf die bislang im Experiment unerreichte Wachstumsgeschwindigkeit von einem Zentimeter pro Tag und eine Länge von bis zu zehn Zentimetern; dieser Wert ist wahrscheinlich noch steigerbar.
Leitfähiges Polymer statt Kupferdraht
Diese durch Dehnung gewachsenen Axone fanden eine ihrer ersten Anwendungen als "lebende Brücke" oder genauer als "Leitfaden" im Wortsinn: um nämlich peripheren Nerven, die durch eine Verletzung oder eine Operation durchtrennt worden waren, den richtigen Weg beim Wachstum zu weisen. Als wir bei Ratten solche Axonbündel mit einem Ende nahe der Stelle implantierten, wo der Nerv durchschnitten worden war, wuchs dieser den Leitfaden entlang – in Einzelfällen so weit, dass der Nerv völlig wiederhergestellt wurde und die Ratten den zuvor gelähmten Körperteil wieder bewegen konnten.
Außerdem stellten wir fest, dass unsere neuronalen Brücken mindestens vier Monate nach der Transplantation noch vorhanden waren. Sie waren weder resorbiert worden, noch hatten sie eine Immunreaktion ausgelöst. Als Nächstes werden wir die Technik nun an Schweinen erproben. Und falls diese Experimente ebenfalls erfolgreich verlaufen, werden wir Studien an Menschen mit noch frischen Nervenverletzungen durchführen.
Nachdem es uns also gelungen war, ein abgeschnittenes Axon ein gutes Stück in eine von uns gewählte Richtung wachsen zu lassen, versuchten wir, eine wesentlich kompliziertere Brücke zu bauen: Der Nerv sollte an eine elektrische Verbindung heranwachsen, die dann an eine Prothese anzuschließen wäre. Dazu mussten wir ein elektrisch leitfähiges Material in Form eines sehr dünnen Fadens finden, das vom Immunsystem des Körpers nicht als fremd wahrgenommen und abgestoßen wird. Nach einigem Ausprobieren entschieden wir uns für eine Klasse von Polymeren; ihr bekanntester Vertreter ist Polyanilin, eine stickstoffhaltige organische Substanz. Ihre elektrische Leitfähigkeit war schon lange bekannt, allerdings zwischenzeitlich in Vergessenheit geraten; erst seit den frühen 1980er Jahren ist der Stoff Gegenstand intensiven wissenschaftlichen Interesses. Forschungsergebnisse anderer Gruppen lassen vermuten, dass der Körper ihn toleriert. Zumindest haben diese spezialisierten Polymere in Versuchen an Nagern keine starke Immunreaktion ausgelöst.
Im nächsten Schritt geht es darum, ein Bündel im Labor gezüchteter Neurone dazu zu veranlassen, um das Ende eines solchen Kunststofffadens herumzuwachsen. Deren Axone würden wir mittels "stretch-grow" verlängern und dann so implantieren, dass der abgetrennte Nerv die Axone als Leitfaden nutzen und schließlich ersetzen würde, einschließlich der Anlagerung an den Polymerfaden. Wenn dies gelingt, ist der Rest eine einfache Anwendung von Elektronik: Die Faser nimmt die Impulse des Nervs auf und leitet sie an einen Verstärker mit angeschlossenem Sender weiter, der mitsamt der Stromquelle unter der Haut implantiert ist. Über einen Empfänger, den der Patient sich umbindet, gelangen die Bewegungsbefehle schließlich zur Prothese, ohne dass dem Patienten ein Draht im Körper stecken müsste.
Die Verbindung sollte auch in umgekehrter Richtung funktionieren: Ein sensorischer Nerv, der mit Hilfe einer in Kultur gewachsenen Brücke den Weg zu einem Polymerfaden gefunden hat, wird durch elektrische Signale von Sensoren in der Prothese erregt und meldet dem Gehirn, dass zum Beispiel der künstliche Zeigefinger auf Widerstand gestoßen ist.
In Experimenten mit Ratten fanden wir, dass unsere Nervenbrücke die nachwachsenden Axone des ursprünglichen Nervs bis auf wenige hundertstel Millimeter an den Polymerfaden heranführt. Das ist ausreichend nah für eine Signalübertragung in beide Richtungen. Bislang haben unsere Hybride aus biologischem und künstlichem Material die Transplantation mehr als einen Monat überdauert und den Kontakt mit dem ursprünglichen Nerv aufrechterhalten. Wir nehmen daher an, dass das Immunsystem sie bereitwillig toleriert, da es sie ansonsten innerhalb weniger Tage zerstört hätte. Weitere Untersuchungen mit längeren Zeitabschnitten werden derzeit durchgeführt.
Unser Biohybrid-Ansatz ist zwar viel versprechend, steckt aber noch in den Kinderschuhen. Noch wissen wir nicht, wie lange solche Brücken funktionsfähig sind und ob unser Immunsystem diese Polymere langfristig toleriert. Darüber hinaus müssen wir Störungen durch andere elektrische Geräte minimieren und die "Empfangsqualität" erhöhen, das heißt, die Nervensignale, die von der Brücke zur Prothese gelangen, von Störungen befreien, so dass sie präziser interpretiert werden. Und schließlich haben wir noch keine Garantie dafür, dass das Gehirn eingehende Signale, die aus der Prothese stammen, sinnvoll interpretieren kann.
Allerdings geben Erfahrungen mit Handtransplantaten Anlass zum Optimismus. Bei einer solchen Transplantation verbindet der Chirurg zwar jeden Nerv aus dem Stumpf des Empfängers mit dem zugehörigen Nerv der Spenderhand; aber einzelne Nervenfasern korrekt zu verknüpfen ist unmöglich. Solche Präzision scheint allerdings auch nicht erforderlich zu sein. Offensichtlich zeichnet das Gehirn seine eigene innere Landkarte um, während es lernt, mit der neuen Hand umzugehen. Auf ähnliche Weise wird es auch eine Roboterhand bewegen können – wenn auch wahrscheinlich erst nach ausgiebigem Training.
Für weitere Fortschritte in der Steuerung von Prothesen werden die Forscher wohl die Ergebnisse aus den verschiedenen Ansätzen zusammenführen müssen. Nach dem gegenwärtigen Stand bieten direkte Verknüpfungen zwischen dem Gehirn und modernen Prothesen – durch direktes Anzapfen der Signale im Großhirn, durch umfunktionierte Brustmuskeln oder über Biohybrid-Brücken – die besten Erfolgsaussichten, einen künstlichen Arm so elegant zu bewegen und als so natürlich zu empfinden wie den ursprünglichen eigenen.
Wie Luke Skywalker seinen neuen Arm bewegte, hat er nie verraten. Aber die Wissenschaftler sind auf gutem Wege, das herauszufinden.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.