Zellbiologie: Ermüdungserscheinungen
Genug ist genug, auch beim Ausdauertraining - sonst summieren sich feine Belastungsrisse bald zu größeren Schäden als nur einem Muskelkater. Auch auf zellulärer Ebene beginnen Physiologen jene Zahnrädchen kennen zu lernen, die unter dauernder Überbelastung als erste nachgeben.
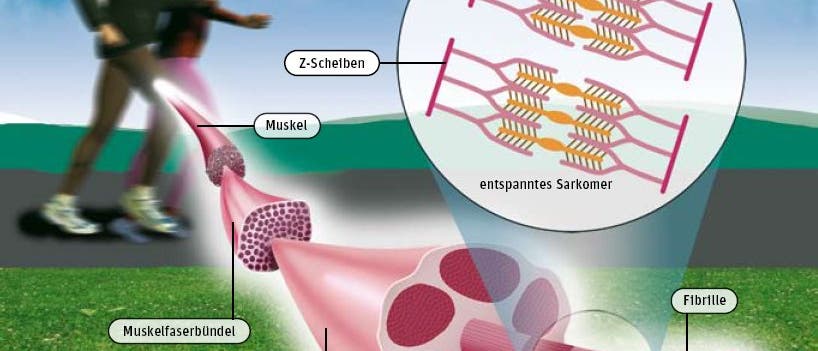
© Spektrum der Wissenschaft / Thomas Braun, Heidelberg (Ausschnitt)
"Erschöpfung" ist etwas ärgerlich Diffuses, Unbefriedigendes für Forscher wie Andrew Marks – etwas zu wenig Fassbares. Der Physiologe von der Columbia-Universität in New York arbeitet in seinem Forschungsgebiet – der Muskelphysiologie – daher an einer handfesten Präzisierung des Begriffes: daran, genau festzunageln, was wo und wann nicht mehr funktionieren will im Hochleistungsapparat Muskel, wenn er zu erschöpft ist, einen allerletzten Klimmzug auszuführen, sowie daran, was im Muskel zwackt, reißt oder überdehnt, sobald der Versuch mit übertriebenem Ehrgeiz erzwungen wird. Und – medizinisch etwa auf dem Gebiet der Infarktforschung am wichtigsten – auch daran, was bei einer dauerhaften Überlastung in Muskeln wie dem eines geschwächten Herzens leidet.
Wirklich handfeste Erkenntnisse sind auf dem Forschungsgebiet "Muskelüberlastung" erstaunlich rar – vor Kurzem etwa stritten manche gar noch über die seit einem guten Jahrhundert kursierende Hypothese, nach der die im angestrengten Skelettmuskel produzierte Milchsäure für alle physiologischen Schäden und Leistungseinbußen sorge. Zellbiologisch detaillierte Mängellisten über die Folgen muskulärer Überbelastung blieben indes kurz und lückenhaft. Marks und Kollegen wollten dies nun ändern und analysierten daher den Muskelzellaufbau von im Labor bis zur Erschöpfung ausdauertrainierten Versuchsmäusen sowie von übergut trainierten menschlichen Sportlern.
Stotternde Details
Dabei ist einiges im Auge zu behalten: Im Räderwerk des Muskels greifen eine Vielzahl von Proteinzahnrädern ineinander, um eine Muskelkontraktion zu gewährleisten; alle dürften, so sie ausfallen, die Leistung des Gesamtsystems schwächen. Insbesondere die bewegten Verschleißteile im Muskel sind allerdings auf den ersten Blick verdächtig, bei Überlastung auszufallen – also etwa die ineinander gleitenden Eiweißfäden Aktin und Myosin oder das aus Elastizitätsgründen eingebaute Muskel-Gummiband aus dem Protein Titin. Tatsächlich weiß man aus früheren Untersuchungen, dass diese Strukturelemente nach ungewohnter oder übermäßiger Belastung bei zwanzig bis dreißig Prozent der Muskelfasern beschädigt sind. Meist können solche akuten Schäden aber innerhalb von Stunden oder Tagen regeneriert werden.
Marks und Kollegen konzentrierten ihren Blick auf der Suche nach Schäden durch chronische Überlastung noch eine Detailstufe tiefer – auf Verschleißteile, bei denen nicht große Fasern, sondern einzelne Proteine ständig arbeiten, um stetig geforderte Muskelkontraktionen zu gewährleisten. Hierzu gehören zum Beispiel die Proteinkomplexe der Ionenkanäle, die Kalzium aus den Vorratsspeichern, den sarkoplasmatischen Retikuli, in die Muskelzellen strömen lassen, sobald diese einen Befehl zur Kontraktion erhalten.
Die entscheidenden Kalziumkanäle sind als Typ-1-Ryanodin-Rezeptoren (RYR1) bekannt und liegen in der Membran der Kalzium-Speicher. Sie öffnen sich unter dem Einfluss benachbarter, spannungsabhängiger Membranproteine – werden diese aktiv, so sorgt letztlich eine Interaktion weiterer Proteine des Rezeptorkomplexes dafür, die Türflügel des Kalzium-Portals aufzuschlagen. Daran sind eine Reihe kleinerer Hilfsmotoren beschäftigt – und eben diese Hilfsmotoren beginnen unter der Dauerbelastung ständigem Türöffnens und -schließens irgendwann zu stottern, wie Marks und sein Team mit den Muskelgewebeproben erschöpfter Mäuse ermittelten.
Wie sie zusammenfassen, beginnt der dauerbeschäftigte Rezeptor zu schwächeln, sobald er zu häufig an einer Stelle per Phosphatsignal sowie an einer zweiten mit einem Stickstoff-Molekül verbunden und aktiviert wird – unter anderem dies sorgt für eine dezente Anpassung der Reaktion des Gesamtkomplexes an die übertriebenen Anforderungen, die im Endeffekt dazu führen, dass die Kalziumkanäle sich nicht mehr vollständig schließen.
Das deswegen stetig in die Muskelzellen leckende Kalzium-Rinnsal senkt dann die Kontraktionskraft der Muskelfasern, hat aber zudem noch weiter gehende Folgen, wie Marks und Kollegen vermuten. So schaltet Kalzium in den Zellen zum Beispiel das Eiweiß abbauende Enzym Calpain ein, wie die Forscher in den Muskelproben erkannten. Unter der Wirkung dieses Proteins werden die übertrainierten Muskelproteine dann stärker angegriffen – womit der Trainingseffekt in das Gegenteil umschlagen könnte.
Zuviel Sport macht leck
Die fatalen Effekte der Rezeptorüberaktivierung und der daraus resultierenden Kalzium-Leckage zeigten sich bei Muskelbiopsien von Sportlern, die drei Stunden täglich sehr intensiv über einige Tage trainiert hatten, so Marks. Nach einigen Tagen Ruhepause spielte sich bei den Athleten allerdings wieder das normale Maß der Rezeptoraktivität ein, die zellulären Erschöpfungssymptome verschwanden. Genau das aber ist offenbar nicht der Fall bei Menschen mit Herzmuskelschwäche, bei denen nach Marks Meinung genau dieselben Veränderungen der Kalzium-Rezeptoren vorliegen.
Um dies zu überprüfen, testeten sie einen derzeit in der Entwicklung bestimmten Wirkstoff, der die Kalziumkanäle wieder fest schließt, an einer weiteren Gruppe ihrer übertrainierten Mäusen. Und tatsächlich zeitigte dies auch den gewünschten Nachweiseffekt: Die Tiere begannen erst sehr viel später zu erschöpfen und auch die muskulären Veränderungen an den Rezeptoren zeigten sich erst nach längeren Trainingsphasen. Damit, so hoffen die Wissenschaftler, könnte tatsächlich ein Wirkungsmechanismus aufgedeckt sein, der bei Menschen mit Herzschwäche noch weit sinnvoller ausgenutzt werden könnte als bei erschöpften – oder auf illegalen Wegen siegeswilligen – Sportlern.
Wirklich handfeste Erkenntnisse sind auf dem Forschungsgebiet "Muskelüberlastung" erstaunlich rar – vor Kurzem etwa stritten manche gar noch über die seit einem guten Jahrhundert kursierende Hypothese, nach der die im angestrengten Skelettmuskel produzierte Milchsäure für alle physiologischen Schäden und Leistungseinbußen sorge. Zellbiologisch detaillierte Mängellisten über die Folgen muskulärer Überbelastung blieben indes kurz und lückenhaft. Marks und Kollegen wollten dies nun ändern und analysierten daher den Muskelzellaufbau von im Labor bis zur Erschöpfung ausdauertrainierten Versuchsmäusen sowie von übergut trainierten menschlichen Sportlern.
Stotternde Details
Dabei ist einiges im Auge zu behalten: Im Räderwerk des Muskels greifen eine Vielzahl von Proteinzahnrädern ineinander, um eine Muskelkontraktion zu gewährleisten; alle dürften, so sie ausfallen, die Leistung des Gesamtsystems schwächen. Insbesondere die bewegten Verschleißteile im Muskel sind allerdings auf den ersten Blick verdächtig, bei Überlastung auszufallen – also etwa die ineinander gleitenden Eiweißfäden Aktin und Myosin oder das aus Elastizitätsgründen eingebaute Muskel-Gummiband aus dem Protein Titin. Tatsächlich weiß man aus früheren Untersuchungen, dass diese Strukturelemente nach ungewohnter oder übermäßiger Belastung bei zwanzig bis dreißig Prozent der Muskelfasern beschädigt sind. Meist können solche akuten Schäden aber innerhalb von Stunden oder Tagen regeneriert werden.
Marks und Kollegen konzentrierten ihren Blick auf der Suche nach Schäden durch chronische Überlastung noch eine Detailstufe tiefer – auf Verschleißteile, bei denen nicht große Fasern, sondern einzelne Proteine ständig arbeiten, um stetig geforderte Muskelkontraktionen zu gewährleisten. Hierzu gehören zum Beispiel die Proteinkomplexe der Ionenkanäle, die Kalzium aus den Vorratsspeichern, den sarkoplasmatischen Retikuli, in die Muskelzellen strömen lassen, sobald diese einen Befehl zur Kontraktion erhalten.
Die entscheidenden Kalziumkanäle sind als Typ-1-Ryanodin-Rezeptoren (RYR1) bekannt und liegen in der Membran der Kalzium-Speicher. Sie öffnen sich unter dem Einfluss benachbarter, spannungsabhängiger Membranproteine – werden diese aktiv, so sorgt letztlich eine Interaktion weiterer Proteine des Rezeptorkomplexes dafür, die Türflügel des Kalzium-Portals aufzuschlagen. Daran sind eine Reihe kleinerer Hilfsmotoren beschäftigt – und eben diese Hilfsmotoren beginnen unter der Dauerbelastung ständigem Türöffnens und -schließens irgendwann zu stottern, wie Marks und sein Team mit den Muskelgewebeproben erschöpfter Mäuse ermittelten.
Wie sie zusammenfassen, beginnt der dauerbeschäftigte Rezeptor zu schwächeln, sobald er zu häufig an einer Stelle per Phosphatsignal sowie an einer zweiten mit einem Stickstoff-Molekül verbunden und aktiviert wird – unter anderem dies sorgt für eine dezente Anpassung der Reaktion des Gesamtkomplexes an die übertriebenen Anforderungen, die im Endeffekt dazu führen, dass die Kalziumkanäle sich nicht mehr vollständig schließen.
Das deswegen stetig in die Muskelzellen leckende Kalzium-Rinnsal senkt dann die Kontraktionskraft der Muskelfasern, hat aber zudem noch weiter gehende Folgen, wie Marks und Kollegen vermuten. So schaltet Kalzium in den Zellen zum Beispiel das Eiweiß abbauende Enzym Calpain ein, wie die Forscher in den Muskelproben erkannten. Unter der Wirkung dieses Proteins werden die übertrainierten Muskelproteine dann stärker angegriffen – womit der Trainingseffekt in das Gegenteil umschlagen könnte.
Zuviel Sport macht leck
Die fatalen Effekte der Rezeptorüberaktivierung und der daraus resultierenden Kalzium-Leckage zeigten sich bei Muskelbiopsien von Sportlern, die drei Stunden täglich sehr intensiv über einige Tage trainiert hatten, so Marks. Nach einigen Tagen Ruhepause spielte sich bei den Athleten allerdings wieder das normale Maß der Rezeptoraktivität ein, die zellulären Erschöpfungssymptome verschwanden. Genau das aber ist offenbar nicht der Fall bei Menschen mit Herzmuskelschwäche, bei denen nach Marks Meinung genau dieselben Veränderungen der Kalzium-Rezeptoren vorliegen.
Um dies zu überprüfen, testeten sie einen derzeit in der Entwicklung bestimmten Wirkstoff, der die Kalziumkanäle wieder fest schließt, an einer weiteren Gruppe ihrer übertrainierten Mäusen. Und tatsächlich zeitigte dies auch den gewünschten Nachweiseffekt: Die Tiere begannen erst sehr viel später zu erschöpfen und auch die muskulären Veränderungen an den Rezeptoren zeigten sich erst nach längeren Trainingsphasen. Damit, so hoffen die Wissenschaftler, könnte tatsächlich ein Wirkungsmechanismus aufgedeckt sein, der bei Menschen mit Herzschwäche noch weit sinnvoller ausgenutzt werden könnte als bei erschöpften – oder auf illegalen Wegen siegeswilligen – Sportlern.

Schreiben Sie uns!