Biophysik: Heiß konzentriert an der Schwelle zum Leben
Der Ursprung des Lebens könnte an heißen Quellen der Tiefsee gelegen haben. Wenn dort nicht die vorbiologische Ursuppe reichlich dünn gewesen wäre. Kein Problem, verkünden nun Münchner Forscher. Nach ihren Ergebnissen sorgten Hitze und Löcher für den nötigen Molekülgehalt.
© P. Rona (Ausschnitt)
Eigentlich war alles da. Verbindungen von Kohlenstoff, Stickstoff, Sauerstoff und Wasserstoff sind allgegenwärtig im Weltraum. Und selbst einfache Zucker, Basen und Aminosäuren gibt es in erstaunlicher Vielfalt. Ein bunter Mix von Biomolekülen, die mit großer Wahrscheinlichkeit schon auf der frühen Erde vor etwa vier Milliarden Jahren durch die Meere getrieben sind. Mithin alle Zutaten einer Ursuppe, aus der sich im Handumdrehen ein lebendiger Ozean entwickelt könnte. Wenn da nicht ein lästiges Problem wäre: Für den entscheidenden Schritt vom biochemischen Minimolekül zum biochemischen Makroriesen und schließlich zur ersten Protozelle war das Material viel zu dünn gesät. Die Natur musste in jenen Urzeiten also einen ganz besonderen Trick angewandt haben, um die Zutaten des Lebens ausreichend aufzukonzentrieren. Nur welchen?
Die Liste der Vorschläge, mit denen Wissenschaftler das Konzentrationsproblem zu lösen versuchen, ist lang und reicht von katalytischen Gesteinen bis hin zu verdunstenden Pfützen. Bei aller Unterschiedlichkeit ist ihnen eines gemeinsam: Sie setzen eine ordentliche Portion glücklichen Zufall voraus. Anders dagegen eine neue Idee, die ein Team von Physikern, Biochemikern und Geologen um Dieter Braun von der Ludwig-Maximilians-Universität in München nun vorgestellt hat. Danach wird die Ursuppe zwangsläufig dicker, wenn sie nur in enge Röhrchen mit eingebautem Temperaturgefälle gefüllt ist.
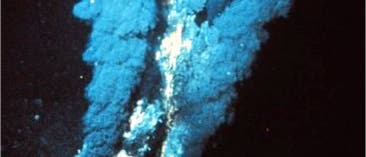
Was sich zunächst nach typischen Laborbedingungen anhört, ist in der Tiefsee geologischer Alltag. An den mittelozeanischen Rücken tritt an sogenannten hydrothermalen Quellen über 100 Grad Celsius heißes, mineralreiches Wasser aus dem Boden und trifft auf kaltes Meerwasser, dessen Temperatur knapp über Null Grad liegt. Die Kälte lässt die Mineralien ausfallen. Es entstehen Sedimente, die nicht nur von unzähligen Poren durchzogen sind, sondern auf der Quell-zugewandten Seite kräftig gewärmt und am abgewandten Ende ordentlich gekühlt werden. Genau das Szenario, in dem sich Biomoleküle angeblich gerne ansammeln.
Verantwortlich für diese wundersame Konzentrierung ist die sogenannte Thermodiffusion – die Bewegung von Molekülen in einem Wärmegefälle. In einer Reihe vorhergehender Versuche hatten die Münchner Forscher gezeigt, dass sowohl winzige Kunststoffkügelchen als auch DNA-Moleküle unterschiedlicher Länge zu wandern anfangen, wenn in ihrem Lösungsmittel ein Temperaturgradient herrscht. Antrieb ist dabei die Entropie – ein thermodynamisches Maß für die Beliebigkeit, mit der sich das Medium und die gelösten Stoffe anordnen können. Herrscht ausreichend Platz, wirkt zusätzlich noch die Konvektionsströmung des Wassers. Sie reißt die Teilchen einfach mit sich. Zusammen spülen Diffusion und Konvektion gelöste Moleküle in Regionen, wo sich die Kräfte aufheben – ein Mechanismus, der die Konzentration im Experiment um das Mehrtausendfache steigerte.
So ein Ablauf könnte die Ursuppe in den Gesteinsporen ausreichend verdicken. Doch leider sind ausgerechnet diese Hohlräume experimentell kaum zugänglich. Ihre Durchmesser liegen im Bereich von hundertstel und zehntel Millimetern – jede Präparation oder Messsonde würde die empfindlichen Molekülansammlungen sofort zerstören. Darum versetzten die Wissenschaftler die Tiefsee kurzerhand in den Computer und simulierten die Abläufe mit verschiedenen Porengeometrien. Als wanderndes Molekül wählten sie RNA – einen Verwandten der DNA, der wie diese Informationen speichern kann, aber zusätzlich in der Lage ist, biochemische Reaktionen zu katalysieren. Viele Evolutionsbiologen sind darum der Ansicht, die Bildung längerer RNA-Ketten wäre einer der ersten wichtigen Schritte auf dem Weg zum Leben gewesen.
Der Simulation zufolge hätten die Chancen für eine Verkettung vieler RNA-Bausteine in den Tiefseeporen sehr gut gestanden. Bei einem Temperaturgradienten von 30 Grad Celsius hätte bereits eine Röhrchenlänge von fünf Millimetern ausgereicht, um die RNA-Moleküle auf das 1200-fache zu konzentrieren. Mehrere miteinander verbundene Poren würden sogar Faktoren im Milliardenbereich ermöglichen. Die genaue Geometrie hat dabei nur wenig Auswirkungen auf die Ansammlung. Vielmehr kommt es auf die Länge und den Öffnungsdurchmesser an. "Eine optimale Konzentration der RNA wird in Poren mit einer Breite von 0,15 Millimetern und einer Länge von etwa 40 Millimetern erreicht", sagt Braun. Wird es enger, steigt vor allem die Dichte großer Teilchen, die in einer Art molekularer Falle stecken. "Dabei sammeln sich die Moleküle in einem Bereich, der etwa der Größe moderner Zellen entspricht."
In uralten Zeiten könnte durch Thermodiffusion und Konvektion in den Poren somit die Konzentration an Biomolekülen ausreichend hoch gewesen sein, um eine ausdauernde Biochemie in Gang zu setzen. In freier Natur wäre das heutzutage unmöglich. Längst bewohnen voll funktionstüchtige Bakterienzellen die Hohlräume und werden die antreibenden Rohstoffe für ihre eigenen Zwecke nutzen. Einem sorgfältig kontrolliertem Laborversuch mit künstlicher Tiefsee und synthetischer Ursuppe stünde jedoch nichts im Wege. Es könnte in einer stillen sterilen Ecke vor sich herköcheln und uns vielleicht in ein paar Jahren die Antwort geben, ob wir tatsächlich alle aus der Tiefsee stammen. Aus winzigen Kämmerchen am warmen Ofen heißer Quellen.
Die Liste der Vorschläge, mit denen Wissenschaftler das Konzentrationsproblem zu lösen versuchen, ist lang und reicht von katalytischen Gesteinen bis hin zu verdunstenden Pfützen. Bei aller Unterschiedlichkeit ist ihnen eines gemeinsam: Sie setzen eine ordentliche Portion glücklichen Zufall voraus. Anders dagegen eine neue Idee, die ein Team von Physikern, Biochemikern und Geologen um Dieter Braun von der Ludwig-Maximilians-Universität in München nun vorgestellt hat. Danach wird die Ursuppe zwangsläufig dicker, wenn sie nur in enge Röhrchen mit eingebautem Temperaturgefälle gefüllt ist.
Was sich zunächst nach typischen Laborbedingungen anhört, ist in der Tiefsee geologischer Alltag. An den mittelozeanischen Rücken tritt an sogenannten hydrothermalen Quellen über 100 Grad Celsius heißes, mineralreiches Wasser aus dem Boden und trifft auf kaltes Meerwasser, dessen Temperatur knapp über Null Grad liegt. Die Kälte lässt die Mineralien ausfallen. Es entstehen Sedimente, die nicht nur von unzähligen Poren durchzogen sind, sondern auf der Quell-zugewandten Seite kräftig gewärmt und am abgewandten Ende ordentlich gekühlt werden. Genau das Szenario, in dem sich Biomoleküle angeblich gerne ansammeln.
Verantwortlich für diese wundersame Konzentrierung ist die sogenannte Thermodiffusion – die Bewegung von Molekülen in einem Wärmegefälle. In einer Reihe vorhergehender Versuche hatten die Münchner Forscher gezeigt, dass sowohl winzige Kunststoffkügelchen als auch DNA-Moleküle unterschiedlicher Länge zu wandern anfangen, wenn in ihrem Lösungsmittel ein Temperaturgradient herrscht. Antrieb ist dabei die Entropie – ein thermodynamisches Maß für die Beliebigkeit, mit der sich das Medium und die gelösten Stoffe anordnen können. Herrscht ausreichend Platz, wirkt zusätzlich noch die Konvektionsströmung des Wassers. Sie reißt die Teilchen einfach mit sich. Zusammen spülen Diffusion und Konvektion gelöste Moleküle in Regionen, wo sich die Kräfte aufheben – ein Mechanismus, der die Konzentration im Experiment um das Mehrtausendfache steigerte.
So ein Ablauf könnte die Ursuppe in den Gesteinsporen ausreichend verdicken. Doch leider sind ausgerechnet diese Hohlräume experimentell kaum zugänglich. Ihre Durchmesser liegen im Bereich von hundertstel und zehntel Millimetern – jede Präparation oder Messsonde würde die empfindlichen Molekülansammlungen sofort zerstören. Darum versetzten die Wissenschaftler die Tiefsee kurzerhand in den Computer und simulierten die Abläufe mit verschiedenen Porengeometrien. Als wanderndes Molekül wählten sie RNA – einen Verwandten der DNA, der wie diese Informationen speichern kann, aber zusätzlich in der Lage ist, biochemische Reaktionen zu katalysieren. Viele Evolutionsbiologen sind darum der Ansicht, die Bildung längerer RNA-Ketten wäre einer der ersten wichtigen Schritte auf dem Weg zum Leben gewesen.
Der Simulation zufolge hätten die Chancen für eine Verkettung vieler RNA-Bausteine in den Tiefseeporen sehr gut gestanden. Bei einem Temperaturgradienten von 30 Grad Celsius hätte bereits eine Röhrchenlänge von fünf Millimetern ausgereicht, um die RNA-Moleküle auf das 1200-fache zu konzentrieren. Mehrere miteinander verbundene Poren würden sogar Faktoren im Milliardenbereich ermöglichen. Die genaue Geometrie hat dabei nur wenig Auswirkungen auf die Ansammlung. Vielmehr kommt es auf die Länge und den Öffnungsdurchmesser an. "Eine optimale Konzentration der RNA wird in Poren mit einer Breite von 0,15 Millimetern und einer Länge von etwa 40 Millimetern erreicht", sagt Braun. Wird es enger, steigt vor allem die Dichte großer Teilchen, die in einer Art molekularer Falle stecken. "Dabei sammeln sich die Moleküle in einem Bereich, der etwa der Größe moderner Zellen entspricht."
In uralten Zeiten könnte durch Thermodiffusion und Konvektion in den Poren somit die Konzentration an Biomolekülen ausreichend hoch gewesen sein, um eine ausdauernde Biochemie in Gang zu setzen. In freier Natur wäre das heutzutage unmöglich. Längst bewohnen voll funktionstüchtige Bakterienzellen die Hohlräume und werden die antreibenden Rohstoffe für ihre eigenen Zwecke nutzen. Einem sorgfältig kontrolliertem Laborversuch mit künstlicher Tiefsee und synthetischer Ursuppe stünde jedoch nichts im Wege. Es könnte in einer stillen sterilen Ecke vor sich herköcheln und uns vielleicht in ein paar Jahren die Antwort geben, ob wir tatsächlich alle aus der Tiefsee stammen. Aus winzigen Kämmerchen am warmen Ofen heißer Quellen.

Schreiben Sie uns!