Regenerative Medizin: Humane Stammzellen aus klonierten Embryonen
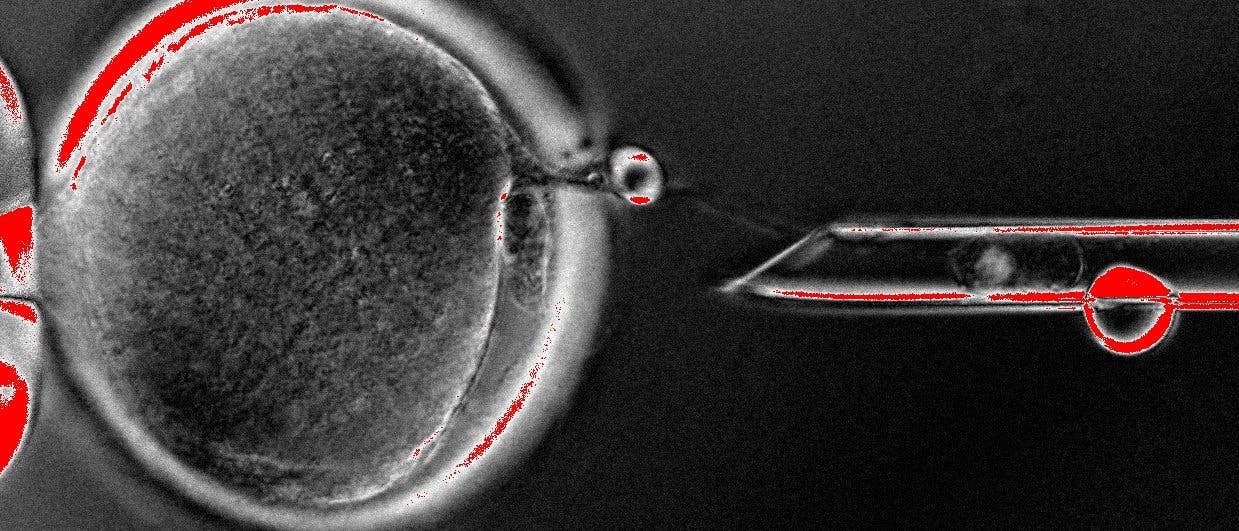
Vor 15 Jahren wurde sie als Hoffnungsträger für eine biomedizinische Revolution gefeiert: die Klonierung. Sie sollte perfekt passende Gewebe hervorbringen, mit denen sich eines Tages Krankheiten von Diabetes bis Parkinson heilen ließen. Seitdem kämpft der Ansatz mit ethischen Diskussionen, ist überschattet von Betrug und verlor zudem in den letzten Jahren angesichts einer konkurrierenden Technologie immer mehr an Bedeutung. Längst haben ihn viele Arbeitsgruppen aufgegeben, weil die Gewinnung patientenspezifischer embryonaler Stammzellen (ESCs) durch Klonierung so ungeheuer schwierig ist. Dem folgte eine leisere Diskussion: Brauchen wir überhaupt therapeutisches Klonen?
Shoukhrat Mitalipov, Fortpflanzungsbiologe an der Oregon Health and Science University in Beaverton, und seine Kollegen haben nun Ergebnisse veröffentlicht, die die Debatte wieder anheizen werden [1]. Denn den Forschern ist genau diese knifflige Aufgabe gelungen: Sie haben patientenspezifische ESCs durch Klonierung hergestellt. Und sie möchten beweisen, dass es sich lohnt, diesen Ansatz weiter zu verfolgen.
Therapeutisches Klonen, oder somatischer Zellkerntransfer (somatic-cell nuclear transfer, SCNT), beginnt mit demselben Prozess, der 1996 auch für Dolly, das berühmte Klonschaf, angewendet wurde: Eine Spenderzelle aus Körpergewebe wie der Haut wird mit einer nicht befruchteten, entkernten Eizelle verschmolzen. Die Eizelle "reprogrammiert" die DNA in der Spenderzelle zurück in den embryonalen Zustand und teilt sich bis zum Blastozystenstadium. Anschließend werden daraus Stammzellen gewonnen und zu stabilen Stammzelllinien kultiviert. Sie können sich zu nahezu jedem Zelltyp des menschlichen Körpers entwickeln. Das Wichtigste daran: Sie stimmen genetisch mit der Spenderzelle überein.
Schon viele Wissenschaftler haben versucht, solche menschlichen SCNT-Stammzelllinien herzustellen, bislang ist es niemandem gelungen. Unvergesslich bleibt der Betrug von Woo Suk Hwang, der an der Nationalen Universität von Seoul in den Jahren 2004 und 2005 zwei Erfolge vermeldete, nachdem er mit hunderten menschlichen Eizellen experimentiert hatte. Beide stellten sich als gefälscht heraus.
Andere Forscher kamen ein Stück weiter. Mitalipov entwickelte im Jahr 2007 SCNT-Linien in Affen [2]. Und Dieter Egli, Regenerationsmediziner an der New Yorker Stem Cell Foundation, produzierte erfolgreich humane SCNT-Linien. Allerdings durfte dabei die Eizelle nicht entkernt werden – die entstandenen Zellen besaßen also eine abnormale Chromosomenzahl, was ihren Nutzen einschränkte.
Ein bisschen Koffein
Die neue Studie der Arbeitsgruppe um Mitalipov begann im September 2012. Die Eizellen stammten von jungen Spenderinnen, die in einer Werbekampagne an der Universität gewonnen wurden. Nach einigen Fehlschlägen begannen im Dezember vier der klonierten Embryonen zu wachsen. "Sie sehen wie Kolonien aus, sie sehen wie Kolonien aus", konnte Mitalipov nur noch denken. Masahito Tachibana, ein Fertilitätsspezialist aus dem japanischen Sendai, dessen 5-Jahres-Vertrag in Mitalipovs Labor sich dem Ende nähert, zerlegte nervös die einen Millimeter winzigen Zellhaufen und transferierte sie auf neue Kulturplatten, wo sie weiterwuchsen – ein Erfolgshinweis. Mitalipov sagte seine Urlaubspläne ab: "Ich verbrachte Weihnachten glücklich im Labor", erzählt er. "Meine Familie hat das verstanden."
Der Erfolg kam durch kleine technische Verbesserungen. Um die Ei- und die Körperzellen zu verschmelzen, nutzten die Wissenschaftler inaktivierte Sendai-Viren: Sie sind bekannt dafür, die Zellfusion zu induzieren. Die Embryonalentwicklung regten sie durch einen leichten Stromstoß an. Als ihre ersten Versuche zwar Blastozysten, aber keine stabilen Zelllinien hervorbrachten, gaben sie ein bisschen Koffein dazu. Es schützt das Ei vor vorzeitiger Aktivierung.
Keine dieser Techniken ist neu. Doch die Forscher testeten sie in verschiedensten Kombinationen in mehr als tausend Affeneizellen, bevor sie zu menschlichen Zellen wechselten. "Sie haben das Protokoll an den richtigen Stellen verbessert", sagt Egli. "Das sind großartige Neuigkeiten. Einfach überzeugend. Ich glaube es."
Das Experiment dauerte dann nur wenige Monate, erzählt Mitalipov. "Viele sagen: Ihr habt es 2007 bei Affen geschafft. Warum hat es sechs Jahre gedauert, bis es nun beim Menschen so weit war?" Die meiste Zeit benötigte das Abklären mit den US-Gesetzen zur Forschung an Embryonen, sagt er.
Mit einer ganzen Reihe von Tests überprüften die Wissenschaftler, dass sich ihre SCNT-Zellen zu verschiedenen Zelltypen entwickeln. Darunter sind auch Herzzellen, die spontan kontrahieren.
Die ersten Zelllinien wurden mit Hilfe fötaler Hautzellen kreiert; andere entstammen Spenderzellen von einem acht Monate alten Kind mit Leigh-Syndrom. Dies zeigte, dass sich ESCs auch aus weiter ausdifferenzierten Zellen züchten lassen. Die Technik erwies sich zudem als hoch effektiv: Eine Zelllinie geht zurück auf 15 Eizellen einer Spenderin, eine weitere auf 5 Eizellen einer andere Spenderin. "Diese Effektivität ist das Beeindruckendste", sagt George Daley, Stammzellexperte am Children's Hospital Boston in Massachusetts.
Solche Fortschritte könnten nötig sein, um die Öffentlichkeit zu überzeugen, dass sich die Forschung an somatischem Zellkerntransfer immer noch lohnt. Die Eizellspenderinnen erhielten 3000 bis 7000 US-Dollar als Vergütung. Das ist viel, und manche Bioethiker fürchten, dass dies einen Organhandel ins Leben rufen könnte, der insbesondere Arme ausnutzt. Da die Technik das Zerstören von Embryonen beinhaltet, können keine Mittel der National Institutes of Health (NIH) dafür eingesetzt werden, was eine weitere klinische Forschung behindert. (Mitalipov leitet noch ein separates Labor für NIH-finanzierte Projekte.)
Die öffentlichen Bedenken vor "menschlichen Klonen" sind eine weitere Hürde. Die Forschungsergebnisse könnten eine "Klonhysterie" auslösen, die Gegnern der Stammzellforschung zu Gute kämen, meint Bernard Siegel, geschäftsführender Direktor am Genetics Policy Institute in Palm Beach. Doch Mitalipov hat mehr als ein Jahrzehnt vergeblich versucht, einen Affen mit dieser Methode zu klonieren. Und Tachibana verweist auf eine noch nicht veröffentlichte Publikation, in der die Forscher darlegen werden, warum ihre SCNT-Methode für das reproduktive Klonen von Menschen ungeeignet ist.
Außerdem haben Daley und die meisten anderen Stammzellforscher inzwischen zu einer anderen Methode gewechselt, um genetisch passende, patientenspezifische Stammzelllinien zu erzeugen: der Reprogrammierung von adulten Zellen in den embryonalen Zustand, um daraus induzierte pluripotente Stammzellen (iPS) zu erzeugen. Die 2006 erstmals vorgestellte Technik benötigt weder Eizellen noch das Klonieren oder Zerstören von Embryonen [4]. "Ehrlich gesagt ist das Überraschendste [an dieser Publikation], dass sich in der Ära der iPS überhaupt noch jemand mit somatischem Zellkerntransfer an menschlichen Zellen beschäftigt", meint Miodrag Stojkovic. Er erforscht die Möglichkeiten von iPS in der regenerativen Medizin und betreibt eine Kinderwunschklinik im serbischen Leskovac.
Doch Stojkovic will, wie andere auch, erst einmal die Ergebnisse eines Kopf-an-Kopf-Vergleichs der iPS und SCNT-Zellen abwarten. Einige Forschungsergebnisse deuten darauf hin, dass iPS nicht vollständig reprogrammiert werden und dass Stammzellen aus SCNT jenen embryonalen Stammzellen ähnlicher sind, die aus in-vitro-Fertilisationen gewonnen werden. Mitalipov und Tachibana arbeiten bereits an einer Studie, in der sie iPS und SCNT-Zellen, die aus Zellen derselben Spender stammen, vergleichen. "Diese Ergebnisse werden faszinierend sein", sagt Daley.
Der Artikel erschien unter dem Titel "Human stem cells created by cloning" in Nature 497, S. 295–296, 2013.
Schreiben Sie uns!
Beitrag schreiben