Lexikon der Biologie: Embryonalentwicklung
Embryonalentwicklung [von *embryo- ], Keimentwicklung, Keimesentwicklung, Embryogenese, Embryogenie, allgemeindie erste Phase in der Individualentwicklung (Entwicklung) eines Lebewesens.
1) Botanik: die Entwicklung eines jungen Organismus aus der befruchteten (Befruchtung, Abb.) oder unbefruchteten (Parthenogenese) Eizelle; a) bei den Moosen bis zur Anlage der Sporangien, b) bei den Farnpflanzen bis zum assimilationsfähigen Keimling (Keimpflanze), c) bei den Samenpflanzen (s.u.) bis zum Embryo im ausbreitungsreifen Samen ( vgl. Abb. ). Die Entwicklung ist in der Regel durch die Lage der Eizelle in den Geschlechtsorganen oder in der Samenanlage gegeben (Polaritätsinduktion). I.w.S. ist unter Embryonalentwicklung auch die Entwicklung der Algen, Pilze, Moose aus Sporen bis zu einem selbständig lebensfähigen Organismus zu verstehen, z.B. der Gametophyten der Braunalgen aus Meiosporen (Gonospore), den sog. „Embryosporen“. – Bei den Samenpflanzen (Bedecktsamer, Nacktsamer) versteht man unter der Embryonalentwicklung die Bildung des bipolaren pflanzlichen Embryos (bestehend aus Wurzel-, Sproß- und Blattanlagen) aus der befruchteten Eizelle (Zygote; vgl. Abb. ) in den Samenanlagen (vgl. auch in vitro-Fertilisierung). Die Embryonalentwicklung wird allgemein durch 3 fundamentale Prozesse bestimmt: Differenzierung (Verschiedenwerden von Zellen aufgrund von differentieller Genexpression), Musterbildung (Anlage und Ausprägung einer nicht-zufallsmäßigen Anordnung von Zellen) und Morphogenese (Entstehung einer spezifischen äußeren Form durch exakte Kontrolle der Rate und Richtung von Zellteilung und Zellwachstum). Sie läßt sich dementsprechend auf 3 Ebenen beschreiben und analysieren: 1) zelluläre Organisation (struktureller und funktioneller Aspekt), 2) Proteinakkumulation (biochemischer Aspekt), 3) mRNA-Akkumulation (genetisch-molekularbiologischer Aspekt). Bei Dikotylen (Zweikeimblättrige Pflanzen) durchläuft der Embryo mehrere ineinander übergehende Stadien ( vgl. Abb. ). Nach einer asymmetrischen Teilung der Zygote entwickelt sich die größere basale Zelle zum Suspensor (Embryoträger), über den die Ernährung des Embryos erfolgt. Die kleinere apikale Zelle erreicht nach 3 äqualen Teilungen über das Proembryo-Stadium das Oktant-Stadium, dessen obere Hälfte sich zu Kotyledonen (Keimblätter) und Apex und dessen untere Hälfte sich zum Hypokotyl entwickelt. Die Wurzel entsteht aus der obersten Zelle des Suspensors. Während des Globulär- und Herz-Stadiums erfolgen die Determination von epidermalen Zellen (Epidermis) und von Leitungsgewebe und Grundgewebe sowie die Etablierung einer bilateralen Symmetrie. Während des Torpedo-Stadiums streckt sich der gesamte Embryo zusehends, und im Kotyledonar-Stadium expandieren in besonderem Maße die Kotyledonen. Im Lauf der Embryogenese degeneriert der Suspensor, und das triploide Endosperm übernimmt die Ernährung des Embryos. – Die Embryogenese bei Monokotylen (Einkeimblättrige Pflanzen) unterscheidet sich durch vorwiegend asymmetrische Zellteilungen und eine weitergehende Entwicklung des Embryos (bereits mehrere Blattanlagen vorhanden). Dieser zygotischen Embryogenese sehr ähnlich verläuft die somatische Embryogenese, allerdings ohne die Beteiligung eines Suspensors. Die Ernährung erfolgt hier über die Kulturmedien. Beiden gemeinsam ist jedoch ein spezifisches und räumliches Muster der Synthese von Proteinen: Enzyme, regulatorische Proteine (Repressoren), Strukturproteine (Skleroproteine), Speicherproteine. Deren Synthese ist transkriptionell und posttranskriptionell reguliert und spiegelt sich in einem entsprechenden Erscheinen der mRNA wider. Die mRNA-Akkumulation läßt sich z.B. durch cDNA-Hybridisierung (cDNA), in-vitro-Translation (in-vitro-Translationssysteme), in-situ-Hybridisierung und Promotor-Trapping (Promotor) untersuchen. Zur Analyse der beteiligten Gene eignen sich besonders Strahlungs-, Transposon- oder chemisch induzierte Mutanten. Mutanten mit einer veränderten Gestaltbildung sind dabei besonders augenfällig und leicht zu untersuchen. Bei Arabidopsis thaliana (Gänserauke, Acker-Schmalwand) wurden zahlreiche Gene identifiziert (Arabidopsis-Genom-Projekt), die an der Morphogenese des Embryos beteiligt sind. Die meisten dieser Gene stehen im Zusammenhang mit formativen Teilungen, wobei 2 Tochterzellen mit verschiedenem Entwicklungsschicksal entstehen. Entscheidend ist dabei die Polarität der sich teilenden Zelle. Im Gegensatz zu den frühen Morphogenese-Genen bei Drosophila (s.u.) sind die bislang identifizierten Embryogenese-Gene bei Arabidopsis keine Transkriptionsfaktoren, sondern codieren für Genprodukte, die vermutlich mit der Steuerung des Vesikeltransports in Zusammenhang stehen. Die molekulare Wirkungsweise dieser Gene ist jedoch ebenso erst in Anfängen verstanden wie die Art und Weise der Kontrolle und Integration der gesamten, sehr wahrscheinlich hierarchisch organisierten Genexpression während der Embryogenese. Im Anschluß an diese Phase der Embryogenese i.e.S. durchläuft der Embryo eine Reifungsphase, in der bei Pflanzen mit KotyledonarspeicherungProteine, Fette oder Kohlenhydrate in den Kotyledonen deponiert werden. Alternativ übernimmt bei Endospermspeicherung das Endosperm die Reservespeicherung. Auch in dieser Phase spiegelt sich die metabolische Aktivität im mRNA-Muster wider. Neben konstitutiven mRNAs gibt es embryospezifische mRNAs, die während der gesamten Reifungsphase oder aber nur in Abschnitten davon synthetisiert werden. Darunter sind auch die mRNAs für die Speicherproteine. Parallel zu diesen Ereignissen entwickelt sich der Samen, in den der Embryo eingeschlossen ist. Gegen Ende der Samenentwicklung tritt der Embryo mit zunehmender Dehydratation in einen Ruhezustand über, aus dem er nach einer unterschiedlich langen Phase der Samenruhe bei Wiederzufuhr von Wasser zur Keimung übergeht. Bedecktsamer (Abb., Farbtafel I), Blüte (Abb.), Nacktsamer (Farbtafel).
2) Zoologie: i.w.S. die Entwicklung eines vielzelligen Tieres von der aktivierten Eizelle (Aktivierung) bis zur selbständigen Nahrungsaufnahme; bei Höheren Wirbeltieren (Säugern) unterteilt in Embryonalentwicklung i.e.S. sowie Fetalentwicklung (Entwicklungsabschnitt nach dem Auftreten von ordnungs- oder gattungsspezifischen Organisationsmerkmalen). Die Embryonalentwicklung umfaßt ein komplexes Wirkgefüge von begrifflich trennbaren Vorgängen, wie Zellteilung (Furchung), Musterbildung, Gestaltungsbewegungen (Morphogenese) und Zelldifferenzierung (Differenzierung), welche jeweils auf unterschiedlichen Ebenen untersucht und beschrieben werden. So untersucht z.B. die molekulare Genetik u.a. die räumlich und zeitlich differentielle Steuerung der Genaktivität (Genregulation, Signaltransduktion) und damit die den morphologischen Veränderungen vorangehenden, nicht sichtbaren Vorgänge während der Embryonalentwicklung, während die Embryologie i.e.S. die morphologisch sichtbaren Veränderungen während der Entwicklung beschreibt, wie z.B. die Furchung ( vgl. Abb. ) oder die morphogenetischen Bewegungen bei der Gastrulation. Beispiele für die Frühentwicklung und Achsenbildung bei einem gut untersuchten wirbellosen Tier (Drosophila) und bei einem Wirbeltier (Xenopus)vgl. Abb. und vgl. Abb. . – Die Embryonalentwicklung liefert häufig nicht nur den definitiven Körper, sondern auch extraembryonale oder Anhangsorgane mit vorübergehender Funktion (Allantois, Embryonalhüllen, Placenta; vgl. Abb. zur Embryonalentwicklung des Huhns). Die Embryonalentwicklung beginnt mit der Furchung, welche die Eizelle über ein (häufig fehlendes) Morula-Stadium (lockerer Zellhaufen; Morula) in einen Blasenkeim (Blastula) verwandelt. Durch Einstülpung der Blastulawand an einer Stelle (Invagination; Embryonalentwicklung I , Abb. 1a, 2a) oder durch Delamination und andere Prozesse entsteht der zunächst zweischichtige Becherkeim (Gastrula,Embryonalentwicklung I , Abb. 3a); seine Organisationsstufe entspricht derjenigen der Hohltiere (Farbtafel I). Bei den Bilateria wird der Keim im Laufe der Gastrulation dreischichtig (Keimblätter; Embryonalentwicklung I , Abb. 4a). Darauf folgt die Organogenese, in der sich die einzelnen Organanlagen absondern und ausformen (Morphogenese, z.B. Neurulation). Im Verlauf der histologischen Differenzierung erlangen sie ihre Funktionsfähigkeit, und der Embryo kann das Juvenilleben beginnen. Diese Vorgänge verlaufen bei einzelnen Tiergruppen sehr unterschiedlich (siehe dort), die Tafeln I und II erläutern wichtige Beispiele. – Die Embryonalentwicklung findet bei den meisten Tieren außerhalb des Körpers statt, d.h., die Eier (Ei) werden vor oder nach der Besamung durch Spermien ( vgl. Abb. ) aus dem weiblichen Körper entlassen. Solche Eier entwickeln sich frei (z.B. viele Meerestiere), werden an geeigneten Orten abgelegt (z.B. Amphibien), die zum Teil zuvor hergerichtet wurden (z.B. viele Insekten, die meisten Reptilien und Vögel; Brutfürsorge). Bei Brutpflege (Farbtafel) können die Eier am Körper eines Elterntieres getragen werden (z.B. viele Skorpione, Spinnentiere und Krebstiere sowie Seepferdchen und Geburtshelferkröte), oder sie werden von einem oder beiden Elterntieren ausgebrütet (brüten). Die Eier können aber auch im weiblichen Körper verbleiben ( vgl. Abb. ), so daß die ganze Embryonalentwicklung dort stattfindet und der Embryo gleichzeitig mit dem Schlüpfen aus dem Ei geboren wird (Ovoviviparie; z.B. Bergeidechse, Kreuzotter). Wird der Embryo während des Heranwachsens von der Mutter ernährt (echte Viviparie), dann bildet er spezielle Organe für den Stoffaustausch aus (z.B. Dottersackplacenta mancher Haie, vergrößerte Kiemen beim Alpensalamander, Chorioallantois-Placenta beim Höheren Säuger). 3)Embryonalentwicklung des Menschen: die Embryonalentwicklung i.w.S., d.h. die gesamte vorgeburtliche (Geburt) Entwicklung des Menschen (Schwangerschaft), dauert, vom Zeitpunkt der Befruchtung an gerechnet, durchschnittlich 270 Tage (vgl. aber Frühgeburt), vom Beginn der letzten Menstruation an knapp 2 Wochen länger. Ab 5 Tagen nach der Befruchtung erfolgt die Einnistung (Nidation, Implantation) des Keims in die Uteruswand (Gebärmutter; vgl. Abb. , vgl. Abb. ), und nach etwa 10 weiteren Tagen beginnt die Gastrulation (Keimblattbildung). Sie dauert bis zum Ende des 1. Entwicklungsmonats an, wird aber bald von der Neurulation (Anlage des Rückenmarks und Gehirns) zeitlich überlagert. Die Entwicklungswochen 4 bis 12 (in der Lit. oft auch 1–12 angegeben) umfassen die sog. Embryonalperiode (Embryonalentwicklung i.e.S.), an deren Ende der Körper als der eines Menschen zu erkennen ist ( vgl. Tab. , vgl. Abb. ). Der Embryonalperiode folgt die Fetalperiode, die mit der Geburt endet. – Bedeutende Beiträge zur Erforschung der Embryonalentwicklung leisteten u.a. Aristoteles, K.E. von Baer, F.M. Balfour, E. van Beneden, T. Boveri, O. Bütschli, A. Dohrn, I. Döllinger, H.A.E. Driesch, H. Fabricius ab Aquapendente, A.W. Goette, R. de Graaf, V. Haecker, W. Harvey, O.W.A. Hertwig, R.C.W.T. Hertwig, W.F.B. Hofmeister, R.A. von Kölliker, E. Korschelt, E.B. Lewis, M. Malpighi, H. Mangold, O. Mangold, J.F. d.J. Meckel, C. Nüsslein-Volhard, C.H. Pander, M.H. Rathke, W. Roux, H. Spemann, E.A. Strasburger, A.F.L. Weismann, E.F. Wieschaus, C.F. Wolff. – Anlageplan (Abb.), asymmetrische Teilung, Blastodermstadium (Abb.), Entwicklung, Entwicklungsbiologie (Geschichte der), formative Teilung, Keimzelldeterminierung, Lokalisierung von mRNA, somatische Embryogenese, zygotische Embryogenese; Biogenetische Grundregel . Embryonalentwicklung IEmbryonalentwicklung IIEmbryonalentwicklung IIIEmbryonalentwicklung IV .
R.B./M.H./P.N./K.N.

Embryonalentwicklung
Querschnitt durch einen Samen des Hirtentäschelkrauts (Capsella bursa-pastoris). Die hufeisenförmigen Keimblätter der künftigen Pflanze haben sich innerhalb des Samens entwickelt. Das den Embryo (Em) umgebende Endosperm (Nährgewebe) unterstützt den Keimvorgang.

Embryonalentwicklung
Embryonalentwicklung bei Zweikeimblättrigen Pflanzen:
1, 2, 3 frühe Teilungsstadien; 4, 5, 6 Ausbildung eines Köpfchens und 7 des Embryos; 8 Lage des Embryos im Fruchtknoten

Embryonalentwicklung
Ablauf der Embryonalentwicklung bei Höheren Pflanzen. a Im Embryosack kommt es nach Befruchtung der Eizelle zu einer formativen Teilung b der neuentstandenen Zygote in eine vakuolisierte Basalzelle (grau) und eine dicht plasmatische Apikalzelle (weiß). Diese erste Teilung legt die Grundlage für die Sproß-Wurzel-Polarität (Pfeile) der Höheren Pflanze. Bei der Arabidopsis-Mutante Gnom ist diese erste Teilung symmetrisch, was sich in einer starken Störung der gesamten Embryonalentwicklung niederschlägt – es fehlten sowohl das Sproß- als auch das Wurzelmeristem und damit die Polarisierung des Embryos. c Aus der basalen Zelle entsteht der Suspensor, ein embryonales Organ, das der Ernährung des eigentlichen Embryos dient und später fast vollständig verschwindet. Nur die oberste Zelle des Suspensors, die sog. Hypophyse, bildet später die Wurzelhaube und geht damit in die spätere Entwicklung mit ein. Aus der apikalen Zelle entsteht dann der eigentliche Embryo, der sich bald in eine äußere Epidermis und einen inneren Corpus gliedert. Zusätzlich zur Längspolarisierung kommt es also nun zu einer Polarisierung in radialer Richtung (Pfeile). d Nach einiger Zeit entstehen in dem zunächst kugelförmigen Embryo zwei weitere Achsen: zum einen eine Polarisierung in Querrichtung, die sich in der Bildung zweier Keimblätter (bei den Dikotylen oder Zweikeimblättrigen) bzw. in der Bildung eines seitlich liegenden Apikalmeristems (bei den Monokotylen oder Einkeimblättrigen) niederschlägt, zum anderen die Konzentration der Zellteilungsaktivität auf die beiden Längspole des Embryos, auf das Apikalmeristem (zwischen den Anlagen der Keimblätter gelegen) und das Wurzelmeristem (der Bereich des eigentlichen Embryos, der an die Hypophyse und damit an den Suspensor grenzt). e Schließlich differenzieren die einzelnen Bereiche des Embryos aus, wobei gerichtetes Zellwachstum eine wichtige Rolle spielt, vor allem bei der Bildung des Hypokotyls und bei der Streckung der Kotyledonen. Danach wird eine hormonell über Abscisinsäure gesteuerte Entwicklungspause eingelegt, womit die Embryonalentwicklung abgeschlossen ist. Die weitere Entwicklung wird erst nach der Keimung des Samens fortgesetzt, folgt nun aber ganz anderen Gesetzmäßigkeiten: Während die Embryonalentwicklung zu einem festgelegten Bauplan führt, ist die pflanzliche Entwicklung nach der Keimung weitgehend offen und wird in hohem Maße durch die Umwelt gesteuert. Erst bei der Blütenentwicklung kehrt die Pflanze wieder zu einer geschlossenen Entwicklung zurück, bei der das Entwicklungsschicksal der beteiligten Zellen verhältnismäßig festgelegt ist.

Embryonalentwicklung
Seeigelembryo im Vierzellstadium (mikroskopische Aufnahme)


Embryonalentwicklung
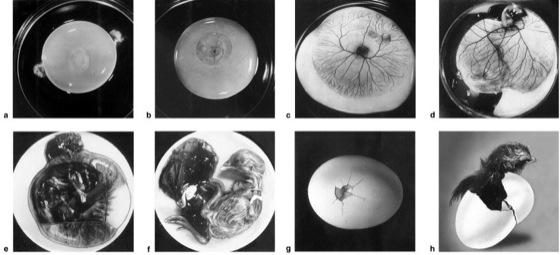
Embryonalentwicklung beim Huhn:
a Bebrütungsdauer 2 Tage: klar erkennbar sind die Keimscheibe auf dem Dotter und die beiden Hagelschnüre am Rand; b Bebrütungsdauer 3 Tage: das vom Embryo ausgehende Netzwerk der Blutgefäße ist auf dem Dotter sichtbar; c Bebrütungsdauer 5 Tage: der Embryo und die Blutgefäße des Dottersacks entwickeln sich weiter; d Bebrütungsdauer 10 Tage: Embryo im Fruchtwasser; die Blutgefäße sind voll ausgebildet; e Bebrütungsdauer 17 Tage: der Embryo ist voll entwickelt; f Bebrütungsdauer 20 Tage: der Embryo kurz vor dem Schlupf; Allantois oben links, in der Mitte der Rest des Dottersacks; g 21. Tag, Schlupftag: Anpicken der Eischale; h das Küken schlüpft nach Sprengen der Eischale aus.
Embryonalentwicklung
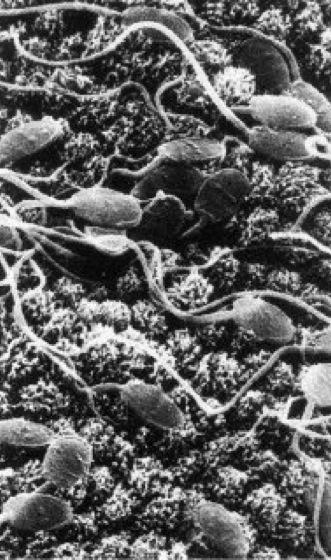
Spermien des Kaninchens

Embryonalenwicklung
Verschiedene Entwicklungsweisen nach innerer Befruchtung:
Die befruchteten Eier können sich außerhalb (z.B. Vögel) oder innerhalb (z.B. Säuger, manche Fische und Kriechtiere) des mütterlichen Organismus entwickeln. Bei lebendgebärenden (viviparen) Wirbeltieren besteht jedoch nur bei Säugetieren eine Ernährungsbrücke zwischen Embryo und elterlichem Organismus. So schlüpfen z.B. bei der Kreuzotter unmittelbar vor oder nach der Geburt die Jungen aus den Eiern (Ovoviviparie).

Embryonalentwicklung
Befruchtung und Entwicklung des Keims beim Menschen:
1 Eisprung, 2 Besamung („Befruchtung“), 3 Begegnung der Zellkerne, 4 vereinigte Kerne, 5 Zweizellen- und 6 Vierzellenstadium, 7 Bildung der ersten Gewebeschichten, 8 Einnisten des Keims in die Gebärmutter.

Embryonalentwicklung
Embryo des Menschen im 8-Zell-Stadium (mikroskopische Aufnahme)

Embryonalentwicklung
Embryonalentwicklung des Menschen:
Verschiedene Phasen in der Ausbildung des Gesichts beim menschlichen Embryo;
a etwa 28 Tage alt, b etwa 6. Woche, c etwa 45 Tage alt, d etwa 8. Woche
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.