Lexikon der Biologie: Glykogen
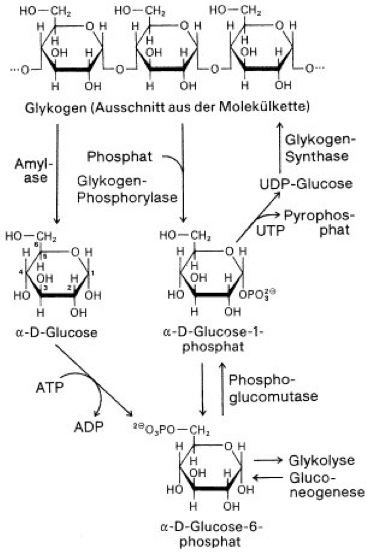
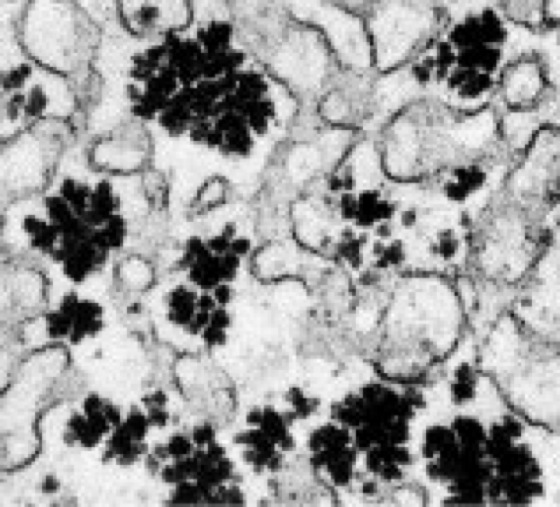
Glykogen s [von *glyko- , griech. gennan = erzeugen], Glycogen, Leberstärke, süßlich schmeckendes Polysaccharid, das aus 5000–100.000 1,4-glykosidisch verknüpften α-D-Glucoseeinheiten (Glucose) mit zusätzlichen 1,6-glykosidischen Verzweigungen (etwa an jeder 10. Glucose-Einheit) aufgebaut ist ( vgl. Abb. 1 ). Glykogen kommt als Energiereservesubstanz (Reservestoffe) generell im Tierreich und bei Pilzen vor, bei Wirbeltieren besonders in der Leber (bis zu 10% des Feuchtgewichts), aber auch im Muskel-Fleisch und Ei-Dotter. Es ist (neben freier Glucose) Ausgangsprodukt der Glykolyse (Farbtafel). – Beim Glykogenabbau (Glykogenolyse) wird es in einem ersten, durch das Enzym Glykogen-Phosphorylase katalysierten Schritt phosphorolytisch zu Glucose-1-phosphat abgebaut oder durch Amylasen hydrolytisch zu Glucose und Maltose gespalten ( vgl. Abb. 2 ). Die Glykogen-Phosphorylase überträgt den Glucoserest vom nichtreduzierenden Ende des Glykogens auf anorganisches Phosphat unter Bildung von Glucose-1-phosphat, das zu Glucose-6-phosphat isomerisiert und dann in den allgemeinen Kohlenhydratabbau (Kohlenhydratstoffwechsel) einfließt. An den Verzweigungspunkten kann es nur durch Hydrolyse gespalten werden, weshalb auch beim phosphorolytischen Abbau neben Glucose-1-phosphat immer ein gewisser Anteil (ca. 10%) an freier Glucose entsteht. Ausgangsverbindung für die Glykogensynthese ist Glucose-6-phosphat, das durch eine Phosphoglucomutase in Glucose-1-phosphat umgewandelt wird. Glucose-1-phosphat kann auch direkt über den Weg der Gluconeogenese bereitgestellt werden. Wichtiges katalytisch wirkendes Cosubstrat ist dabei Glucose-1,6-bisphosphat. Die Glykogensynthese verläuft über ein aktiviertes Zuckerderivat, die Uridindiphosphat-Glucose (UDP-Glucose). Hierbei wird enzymatisch das C-Atom 1 der Glucoseeinheit an das C-Atom 4 des endständigen Glucoserestes eines vorgegebenen Startpolysaccharids angeheftet. Dieser Prozeß wird durch die Glykogen-Synthase katalysiert und wiederholt sich in vielen Schritten bis zur Ausbildung der für das Lebercytosol charakteristischen Glykogengranula ( vgl. Abb. 3 ) von 20–200 nm Durchmesser. Letztere bestehen vorwiegend aus Glykogen, enthalten jedoch in locker gebundener Form auch die Enzyme des Glykogenaufbaus und -abbaus. Die Verzweigungen der Glykogenstruktur kommen dadurch zustande, daß das Enzym Amylo-1,4 →1,6-Transglucosidase (sog. Verzweigungsenzym oder Q-Enzym: branching enzyme) die jeweils zuletzt aneinandergeknüpften 6–7 Glucosereste als Oligosaccharid auf die 6-OH-Gruppe eines Glucoserestes derselben oder einer anderen Glykogenkette überträgt. – Auf- und Abbau von Glykogen sind sowohl nervös über Calcium und Calmodulin als auch hormonell durch Adrenalin, Glucagon und Insulin reguliert. Die Glykogen-Synthase kommt in den Muskeln gewöhnlich in aktiver Form (a) vor, während die Glykogen-Phosphorylase in ihrer inaktiven Form (b) vorliegt. Adrenalin (im Muskel) und Glucagon (in der Leber) führen nach Bindung an die Rezeptoren über heterotrimere G-Proteine zur Aktivierung der Adenylat-Cyclase ( vgl. Abb. 4 ). Das dabei gebildete cAMP aktiviert eine Reihe von Proteinkinasen, u.a. auch die Proteinkinase A (cAMP-abhängige Proteinkinase, PKA), welche die Phosphorylase-Kinase aktiviert. Die Proteinkinase A katalysiert die Phosphorylierung von Glykogen-Synthase, die damit in die weniger aktive b-Form überführt wird, Phosphorylase-Kinase die Phosphorylierung von Glykogen-Phosphorylase, die damit aktiv wird (a-Form). Die Phosphorylierung mobilisiert also den Abbauweg des als Energiereserve gespeicherten Glykogens (Blutzucker). Die von Insulin ausgelöste Signalkaskade führt, vermittelt durch Phosphoprotein-Phosphatase, zur Dephosphorylierung von Glykogen-Synthase und Glykogen-Phosphorylase und damit zur Induktion des Aufbauweges von Glykogen. Ein weiterer Regulationsmechanismus ist die Ca2+/Calmodulin-Abhängigkeit der Phosphorylase-Kinase-Aktivität, was eine Integration der stimulierenden Hormoneffekte und Nervenimpulse (dadurch ausgelöste Ca2+-Freisetzung löst Muskelkontraktion aus) vermittelt. Von wesentlicher Bedeutung sind außerdem allosterische Mechanismen (Allosterie). Die phosphorylierte, weniger aktive Glykogen-Synthase b kann z.B. durch einen hohen Glucose-6-phosphat-Spiegel aktiviert werden. Die inaktive Phosphorylase b kann durch AMP (Adenosinmonophosphat), das aufgrund von Muskelaktivität explosionsartig auftritt, allosterisch aktiviert bzw. der aktivierenden Phosphorylierung zugänglich gemacht werden. ATP und Glucose-6-phosphat wirken entgegengesetzt auf die aktive Phosphorylase a. Die Energiereserve des Glykogens kann mit Hilfe dieser Regulationsmechanismen, im Gegensatz zu der als Langzeitspeicher fungierenden Energiereserve der Fette und Fettgewebe, sehr schnell für den Körper nutzbar gemacht werden. Bernard (C.), Cori (C.F.), Embden (G.), endoplasmatisches Reticulum, Glykogenin, Glykogenose, Hensen (C.A.V.), Homoglykane, Kampf-oder-Flucht-Reaktion, Leloir (L.F.), Meyerhof (O.F.), Sutherland (E.W.), Winterschlaf; Hormone, Stoffwechsel.
H.K./S.Kl./M.B.

Glykogen
Abb. 1: Ausschnitt aus einem Glykogenmolekül
Glykogen
Abb. 2: Abbau und Synthese des Glykogens in der Leber
Glykogen
Abb. 3: Elektronenmikroskopische Aufnahme eines Ausschnitts einer Leberzelle mit Glykogengranula

Glykogen
Abb. 4: Aktivierung des Glykogen-Abbaus durch Adrenalin – ein Beispiel für die Wirkungsweise von extrazellulären Botenstoffen über den intrazellulären second messenger cAMP.
Das Adrenalin bindet an einen spezifischen Rezeptor an der Zelloberfläche z.B. einer Leberzelle. Eine hierdurch initiierte Konformationsänderung des Rezeptors ermöglicht dann Interaktionen mit heterotrimeren G-Proteinen an der Innenseite der Zellmembran. Die hierbei aktivierten G-Proteine sind danach ihrerseits in der Lage, Adenylat-Cyclasen zur Bildung von cAMP aus ATP zu stimulieren. Durch die steigende Menge an intrazellulärem cAMP wird im folgenden eine cAMP-abhängige Proteinkinase A in ihre aktive Form überführt und aktiviert ihrerseits eine Phosphorylase-Kinase. Letztere kann wiederum durch Phosphorylierung die Glykogen-Phosphorylase aktivieren, was zu einem Abbau von Glykogen führt. Die hierdurch freiwerdenden Glucoseeinheiten können direkt für den oxidativen Stoffwechsel der Zelle genutzt oder über Ausschleusung in den Blutstrom dem gesamten System verfügbar gemacht werden. Adrenalin gibt somit von außen der Zelle lediglich den Befehl zur Bereitstellung von Glucose zur Erhöhung des Blutzucker-Spiegels. Die intrazelluläre Reaktionskaskade wird dann durch cAMP angeregt.
Schreiben Sie uns!