Lexikon der Biologie: Glykoproteine
Glykoproteine, veraltete Bezeichnung Glykoproteide,Proteine mit kovalent gebundenen Monosacchariden und/oder Oligosacchariden. Der Proteinteil der Glykoproteine wird von der mRNA (messenger-RNA) translatiert, die Addition des Oligosaccharids ist eine co- und posttranslationelle Modifizierung (posttranslationale Proteinmodifikation). Dies steht im Gegensatz zu den Peptidoglykanen (Murein), bei denen das Kohlenhydratrückgrat strukturell dominiert und durch relativ kurze Polypeptidsequenzen quervernetzt wird, die unabhängig von mRNA und Ribosomen synthetisiert werden. Glykoproteine kommen in Pflanzen und Tieren, jedoch nicht in Bakterien vor (eine Ausnahme stellt ein Glykoprotein von Halobacterium [Halobakterien] dar). Charakteristische Zuckerkomponenten der Glykoproteine sind die Hexosen Galactose, Mannose und seltener Glucose sowie die N-Acetylhexosamine (N-Acetylgalactosamin, N-Acetylglucosamin) und als Kettenendglieder Sialinsäure und Fucose. Die Oligosaccharidketten sind – meist verzweigt und ohne periodische Sequenz – aus im allgemeinen 2–10 Monosaccharideinheiten aufgebaut. Die Anzahl der Saccharidketten auf einem Polypeptid ist sehr unterschiedlich; Ovalbumin (Eieralbumin) enthält 3% Saccharid, während das Schaf-Submaxillaris-Glykoprotein zu 50% aus Kohlenhydrat besteht. Die Sequenzen der Zuckermonomere werden durch die Spezifität der Glykosyl-Transferasen für verschiedene Nucleosiddiphosphat-Zucker bestimmt und möglicherweise auch durch die Konzentrationen der verfügbaren aktivierten Zucker. Folglich weisen die Glykoproteine Mikroheterogenität in ihren Saccharidteilen auf ( vgl. Abb. ). Die Glykoproteine werden am rauhen endoplasmatischen Reticulum (ER) synthetisiert; die wachsende Polypeptidkette erstreckt sich durch die Membran in die extraplasmatische Seite. Im Lumen des ER werden Zuckereinheiten an die Kette addiert, wodurch verhindert wird, daß sie durch die Membran zurückkehrt. Im Fall der N-Glykane wird im ER ein Standardkomplement an Zuckern addiert, das aus 2 N-Acetylglucosamin-, 9 Mannose- und 3 Glucoseeinheiten besteht. Vesikel, die aus dem ER erwachsen, transportieren die Glykoproteine zum Golgi-Apparat, wo einige Zuckereinheiten abgespalten und andere addiert werden, um die für das Protein passende Struktur zu bilden. Das gereifte Glykoprotein kann ausgeschieden, zu einem der Zellorganellen transportiert bzw. in die Zellmembranen inkorporiert werden. – Die Bindung der Mono- bzw. Oligosaccharide an die betreffenden Proteinkomponenten kann auf 3 verschiedenen Wegen erfolgen: 1) O-glykosidisch über die Hydroxylgruppen von Serin-, Threonin- sowie Hydroxylysin- und Hydroxyprolin-Resten. Diese Glykosylierung beginnt posttranslational im ER oder erst im Golgi-Apparat. Dabei wird zunächst ein GalNAc-Rest an die OH-Gruppe der Aminosäure gebunden, weitere Zucker werden einzeln angefügt. 2) N-glykosidisch über terminale Aminogruppen, ω-Aminogruppen von Lysin-Resten bzw. Amidgruppen von Asparagin-Resten. Die N-Glykosylierung an Asparagin-Resten beginnt cotranslational im ER ( vgl. Abb. ) und setzt sich im Golgi-Apparat fort. Auf dem Lipidcarrier Dolicholphosphat (Dolichole) wird zuerst eine große Vorstufe des Oligosaccharids synthetisiert. Die Glykansynthese wird durch die Übertragung von GlcNAc von Uridindiphosphat-N-Acetylglucosamin (UDPGlcNAc) auf Dolicholphosphat initiiert, wobei Dolichol-N-Acetylglucosaminylpyrophosphat gebildet wird. Die Anknüpfung von Mannose- und letztlich Glucoseeinheiten erfolgt in einem geordneten Prozeß, der möglicherweise getrennte, spezifische Mannosyl- und Glucosyltransferasen für jede Stufe benötigt. Das gesamte Endprodukt wird auf einen spezifischen Asparagin-Rest eines Polypeptidakzeptors übertragen (unter Freisetzung von Dolicholpyrophosphat). Als Akzeptoren fungieren sowohl kleine Peptide, die Asparagin enthalten, als auch native Proteine. Das beteiligte Enzym ist für die Struktur –Asn-X-Ser (oder Thr)– spezifisch, wobei X jede Aminosäure sein kann, außer Prolin und möglicherweise Asparaginsäure. Die α-Aminogruppe von Asn und die Carboxylgruppe von Ser (oder Thr) müssen in einer Peptidbindung vorliegen bzw. auf andere Weise blockiert sein. Die weitere Prozessierung beginnt noch im ER mit der Entfernung der 3 Glucosereste. Anschließend erfolgen weitere Modifikationen der Kohlenhydrateinheiten im Golgi-Apparat – je nachdem, ob die Proteine für Lysosomen, für sekretorische Vesikel oder für die Plasmamembran bestimmt sind. 3) Ester-glykosidisch über die Carboxylgruppen von Asparagin- und Glutaminsäure-Resten. – Zu den Glykoproteinen gehören viele Enzyme, die meisten Protein-Hormone (Proteohormone), Plasmaproteine (Serumproteine), Lectine, alle Antikörper, Komplementfaktoren (Komplement), allgemein Zelloberflächenantigene, darunter Komponenten von Blutgruppen (Blutgruppenantigene), Proteine aus Schleim sowie viele Proteine der extrazellulären Matrix (z.B. Fibronektin, Tenascin) und Membranproteine, u.a. membrangebundene Enzyme, Zell-Zell-Kontakte (junctions) und Zell-Substrat-Kontakte vermittelnde Proteine (Adhäsine). Das Glykosylierungsmuster der Glykoproteine hat Informationscharakter. So sorgen sowohl Glykoproteine als auch die Glykolipide für einen gewebe- und zelltypspezifischen sowie entwicklungsabhängigen Aufbau der Zelloberfläche. Das Immunsystem, Viren (Virusrezeptoren) und Spermien z.B. benötigen diese hochspezifischen Muster zur Erkennung und Adsorption an die Zielzelle. Glykoproteine sorgen für die richtige Lokation der Zellen während der Embryonalentwicklung. Auch die membrangebundenen Rezeptoren für Hormone sind Glykoproteine. Intra- und extrazellulär dienen die Oligosaccharidsequenzen als Adressierung für den Proteintransport. Aufgrund ihrer hohen Viskosität haben die Glykoproteine eine Schmier- und Schutzfunktion, z.B. gegen proteolytische Enzyme, Bakterien und Viren. Flüssig-Mosaik-Modell (Abb.), Gefrierschutzproteine, Glykophorine, Hydroxyprolin-reiche Glykoproteine, Membran (Abb.), Mucopolysaccharide, Polyprenolzyklus, Proteoglykane.
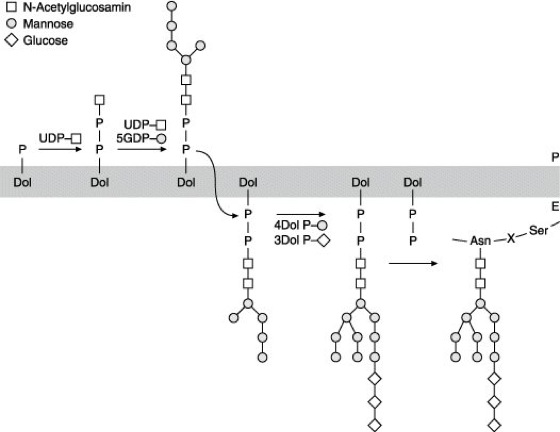
Glykoproteine
N-Glykosylierung: Die Synthese des zentralen Oligosaccharids wird auf der P-Seite des endoplasmatischen Reticulums durch die Übertragung von N-Acetylglucosamin auf Dolicholphosphat (Dol-P) initiiert. Die Anknüpfung eines weiteren N-Acetylglucosamins (GlcNAc) sowie von 9 Mannose- (Man) und 3 Glucoseeinheiten (Glc) erfolgt in einem geordneten Prozeß mittels spezifischer Transferasen. Auf der Stufe des Dol-P-P-GlcNAc2-Man5 kommt es in einem nicht näher charakterisierten Vorgang zur Translokation des Oligosaccharids auf die E-Seite. Das Endprodukt Dol-P-P-GlcNAc2-Man9-Glc3 wird unter Freisetzung von Dolicholpyrophosphat auf einen spezifischen Asparagin-Rest eines Polypeptidakzeptors übertragen. Die weitere Prozessierung beginnt mit der Entfernung der 3 Glucosereste, die Abspaltung von Mannose-Resten geht mit dem Transfer in den Golgi-Apparat einher. Dort erfolgen in Abhängigkeit vom Zielort der Glykoproteine weitere Modifikationen wie die Abspaltung weiterer Mannose-Reste sowie das Anknüpfen von Fucose-, Galactose- und Sialinsäureeinheiten.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.