Lexikon der Biologie: Kaliumkanäle
Kaliumkanäle, Kaliumionenkanäle, K+-Kanäle, transmembranäre Glykoproteine, deren wäßrige Poren für K+ permeabel sind (zur molekularen Struktur ä vgl. Abb. ). Kaliumkanäle bilden die komplexeste Gruppe der Ionenkanäle ( ä vgl. Tab. ). Sie können entweder spannungsabhängig, über freie cytosolische Ca2+-Ionen oder über einen Liganden aktiviert werden. Dadurch kommt es zu einem Kaliumstrom (Kalium) entlang des Kaliumkonzentrations-Gradienten, d.h. meist zu einem Ausstrom von K+ aus der Zelle und damit zu einer Hyperpolarisation der Membran. – Die ausschließlich spannungsabhängigen K+-Kanäle (Kv-Kanäle) werden gemäß ihrer biophysikalischen Eigenschaften in 2 Gruppen unterteilt: 1) Der sog. A-Kanal wird vorübergehend aktiviert und ist auswärts gleichrichtend. Dies bedeutet, daß unter physiologischen Bedingungen K+ nur von innen nach außen fließen kann. In erregbaren Zellen (Nervenzellen, Muskel- und sekretorische Zellen; Erregbarkeit) wird durch die Aktivierung der A-Kanäle die Dauer eines Aktionspotentials limitiert und die Membran repolarisiert. Auf diese Weise tragen die Kanäle zur Kontrolle der Frequenz der Aktionspotentiale bei. Da ihre Aktivierungsschwelle nahe dem Ruhepotential der meisten Zellen liegt, werden sie bereits bei kleinen Depolarisationen aktiviert, jedoch ebenfalls sehr schnell deaktiviert (Öffnungszeit <100 ms). 2) Bei einer stärkeren Depolarisation der Zellmembran werden zudem die verzögert gleichrichtenden K+-Kanäle (delayed rectifiers) aktiviert. Die Aktivierung tritt im Vergleich zum A-Kanal verzögert auf, und auch bei langanhaltenden Depolarisationen wird nur eine langsame Inaktivierung beobachtet. Diese Kanaltypen tragen zur Repolarisation bei und inaktivieren erst bei Erreichen des Ruhemembranpotentials. Man unterscheidet den schnellen verzögert gleichrichtenden K+-Kanal (rapid delayed rectifier) und den langsamen verzögert gleichrichtenden K+-Kanal (slow delayed rectifier), wobei letzterer eine besonders langsame Aktivierung und Inaktivierung sowie eine sehr geringe Leitfähigkeit aufweist. Im Gegensatz zu den beiden vorherigen Klassen wird der einwärts gleichrichtende K+-Kanal (inward rectifier, anomalous rectifier, Kir-Kanal) bei einem Membranpotential, das negativer als das Kalium-Gleichgewichtspotential (ca. –90 mV) ist, aktiviert, was zu einem K+-Einstrom führt. Sobald das Membranpotential positivere Werte annimmt, wird der Auswärtsstrom über intrazelluläre Mg2+-Ionen (Magnesium) und Polyamine wie Spermin unidirektional blockiert. Im Gegensatz zu den Kv-Kanälen wird die Aktivität von Kir-Kanälen also indirekt durch das Membranpotential gesteuert. Die Funktion dieser K+-Kanäle ist die Stabilisierung des Ruhemembranpotentials nahe dem K+-Gleichgewichtspotential. Eine Untergruppe wird zusätzlich über ATP (Adenosintriphosphat) bzw. ein G-Protein kontrolliert. Neben diesen 3 Hauptgruppen existiert im sarkoplasmatischen Reticulum des Muskels (Muskulatur) ein stark spannungsabhängiger K+-Kanal, der jedoch nur eine geringe Selektivität für K+- bzw. Na+-Ionen (Natrium) aufweist. – Die Klasse der Ca2+-abhängigen K+-Kanäle wird über freie, intrazelluläre Ca2+-Ionen (Calcium) bei Konzentrationen im millimolaren Bereich aktiviert. Diese Kanäle sind zusätzlich spannungsabhängig und haben eine den verzögert gleichrichtenden K+-Kanälen entsprechende Kinetik. Sie treten vor allem in erregbaren Zellen mit vorübergehend hohen intrazellulären Ca2+-Konzentrationen auf und tragen in Neuronen zur Nachhyperpolarisation bei. Gemäß ihrer Leitfähigkeit werden sie in 3 Gruppen (high, intermediate und small conductance Ca2+-sensitive K+-channels) unterteilt. – Zur Klasse der second messenger-gesteuerten K+-Kanäle (second messenger-gesteuerte Ionenkanäle) gehören die sog. M-Kanäle in Nervenzellen. Sie werden einerseits durch Depolarisation geöffnet und wirken dann als Bremse weiterer neuronaler Erregung. Andererseits führt die Aktivierung bestimmter Neurotransmitter-Rezeptoren (z.B. muscarinischer Acetylcholinrezeptor, daher das M im Namen) über Vermittlung von G-Proteinen und weiterer (nicht endgültig identifizierter) zweiter Botenstoffe auch zum Schließen der M-Kanäle. So kann der Transmitter Acetylcholin z.B. sympathische Neurone zweifach erregen: zum einen über Aktivierung nicotinischer Acetylcholinrezeptor-Kanäle, zum anderen über Hemmung der M-Kanäle. Daneben existiert ein ebenfalls über muscarinische Acetylcholinrezeptoren aktivierter, einwärts gleichrichtender K+-Kanal am Atrium des Herzens, der möglicherweise direkt über PIP2 (ein Produkt des Inositoltriphosphatzyklus; Phosphatidylinositol-4,5-bisphosphat) aktiviert wird. ATP-abhängige K+-Kanäle werden durch ATP inaktiviert, wohingegen Dinucleotide fazilitierend (bahnend; Bahnung) wirken. Sie sind einwärts gleichrichtend und pH-sensitiv. Ihre Dichte in der Zellmembran ist vergleichsweise hoch, wobei der größte Teil stets inaktiviert vorliegt. Als Funktion wird die Aufrechterhaltung der tonischen K+-Leitfähigkeit nahe des Ruhemembranpotentials postuliert. Das bekannteste Beispiel für ihr Vorkommen ist die Kontrolle der Insulinfreisetzung in den B-Zellen der Bauchspeicheldrüse (Insulin). ATP-abhängige K+-Kanäle werden durch Pharmaka beeinflußt ( ä vgl. Infobox ). In den letzten Jahren wurden zudem am Herzmuskel ein Na+-aktivierter, spannungsunabhängiger Kanal sowie ein Zellvolumen-sensitiver K+-Kanal beschrieben.
Kaliumkanäle
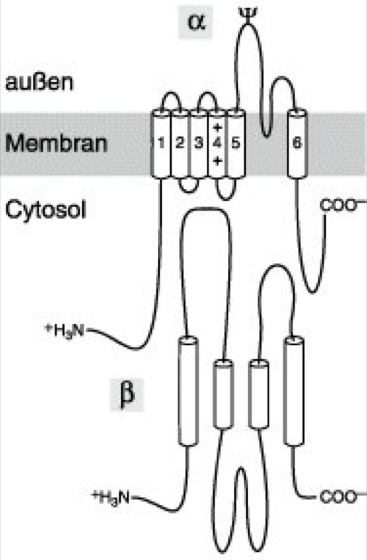
Theoretische transmembranäre Struktur des spannungsabhängigen Kaliumkanals. Essentiell für die Ausbildung funktionsfähiger K+-Kanäle sind transmembranständige α-Untereinheiten. Daneben gibt es auch noch 1 regulatorische, zur cytosolischen Seite gelegene β-Untereinheit. Bei A- und verzögert gleichrichtenden K+-Kanälen bilden 4 α-Untereinheiten – ringförmig angeordnet – die Kanalpore. Die Aminosäuresequenzanalyse läßt auf 6 α-helikale transmembranäre Abschnitte (S1–S6) in einer einzelnen α-Untereinheit schließen. Man geht davon aus, daß alle 4 Untereinheiten mit dem Abschnitt zwischen S5 und S6 zur Bildung der Kanalpore beitragen. Der Spannungssensor (gating charge), dessen Konformationsänderung bei entsprechender Änderung des elektrischen Feldes über die Zellmembran zur Kanalöffnung führt, wird durch positiv geladene Aminosäuren in S4 gebildet. Die Struktur dieser Kanäle ist analog zu spannungsabhängigen Natriumkanälen und Calciumkanälen, deren α-Untereinheiten allerdings nur aus einem Protein mit 4 identischen internen Wiederholungen bestehen. Aufgrund der großen Anzahl beschriebener Untereinheiten ergeben sich bei K+-Kanälen theoretisch Tausende von Kombinationsmöglichkeiten. Die molekularbiologische Klassifizierung der Proteine der α-Untereinheit erfolgt in Analogie für die bei Drosophila melanogaster beschriebenen Genfamilien Shaker, Shawl, Shal, Shab und Slowpoke. Bei den A-Kanälen befindet sich am N-terminalen Ende der Proteinsequenz eine zusätzliche, intrazellulär gelegene Domäne mit positiv geladenen Aminosäureresten (Ball). Im Offen-Zustand (open state) des Kanals kann diese Domäne an einen Rezeptor nahe der inneren Kanalöffnung binden und diese wie mit einem Korken verstopfen. Dies führt zur Inaktivierung, nicht aber zum Schließen des Kanals. Beim Verlassen der Öffnung geht der Kanal in den Offen-Zustand über und wird wieder permeabel. In Xenopus-Oocyten (Amphibienoocyte) führt eine Expression von ausschließlich α-Untereinheiten des A-Kanal-Typs zu funktionsfähigen K+-Kanälen. Im Gegensatz zur unveränderten Aktivierungskinetik ist hier die Inaktivierung jedoch über 100fach verlangsamt. Bei einer Co-Expression mit der entsprechenden β-Untereinheit entstehen andererseits K+-Kanäle mit einer für den A-Strom typischen Kinetik. Bei den bisher identifizierten β-Untereinheiten bestimmt die Länge des N-terminalen Endes die Geschwindigkeit der Inaktivierung des K+-Kanals. Daher scheint die β-Untereinheit für die Kinetik eines Kanals entscheidend zu sein.
Eine Ausnahmestellung nimmt der high conductance Ca2+-sensitive K+-channel ein, der über 7 transmembranäre Abschnitte der α-Untereinheiten und 1 transmembranäre β-Untereinheit verfügt. Bei ligandenaktivierten K+-Kanälen besteht die α-Untereinheit, soweit bekannt, aus einem Heteromultimer von Untereinheiten. Eine eigene Familie bilden die einwärts gleichrichtenden und ATP-abhängigen K+-Kanäle, bei denen die α-Untereinheit aus 1 Homo- oder Heteromultimer mit nur jeweils 2 transmembranären Abschnitten besteht. Hinzu kommt eine regulatorische Untereinheit mit bis zu 17 transmembranären Abschnitten, die wahrscheinlich die ATP-Sensitivität der Kanäle kontrolliert. (Die 3 bzw. 4 letztgenannten Kanal-Typen sind in der Abb. nicht berücksichtigt.)
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.