Lexikon der Biologie: Muskelkontraktion
Muskelkontraktionw [von latein. contractio = Zusammenziehung], Zusammenziehung (Verkürzung) von Muskeln. Jegliche Muskelkontraktion ist das Resultat zahlreicher asynchron verlaufender Verkürzungen der einzelnen Muskelzellen oder Muskelfasern, letztlich ihrer subzellulären kontraktilen Elemente, der Myofibrillen, und sie erfolgt bei allen Muskeltypen unter ATP-Verbrauch (Adenosintriphosphat) aufgrund der gleichen molekularen Grundprozesse (kontraktile Proteine, Muskelproteine), welche an der hochgeordneten quergestreiften Muskulatur der Wirbeltiere am besten untersucht sind. Lichtmikroskopisch erscheint die Muskelkontraktion als eine Verkürzung der einzelnen Sarkomeren (Muskulatur), d.h. ein Zusammenrücken der Z-Scheiben oder Z-Streifen, wobei die I-Zonen der Querbänderung schmäler werden und im Extremfall verschwinden. Wie aus hochauflösenden elektronenmikroskopischen Aufnahmen zu erschließen ist, geht die Muskelkontraktion mit einem zyklischen Binden und Lösen von Querbrücken zwischen Actinfilamenten und Myosinfilamenten einher. Dabei hangeln sich die letzteren mit ihren beweglichen und seitlich abstehenden HMM-Köpfen (HMM = heavy meromyosin) an den umgebenden Actinfilamenten entlang, so daß Actin- und Myosinfilamente zunehmend weiter zwischeneinandergleiten (sliding-filament-Mechanismus). Der einzelne Kontraktionszyklus verläuft folgendermaßen: Im Ausgangszustand der ruhenden ATP-reichen Muskelfaser liegen Actin- und Myosinfilamente getrennt vor und können passiv aneinander entlanggleiten (Muskelerschlaffung), da das Actin durch ATP aus einer möglichen Bindung an die Myosinköpfe (Myosin) verdrängt ist. Die ATP-beladenen Myosinmoleküle ihrerseits sind in einer energiereichen gestreckten Konformation „vorgespannt“. Da die korrespondierenden Myosin-Bindeorte am Actin durch Tropomyosin/Troponin sterisch blockiert sind, bleibt die Actin-aktivierbare Myosin-ATPase (Adenosintriphosphatasen) inaktiv. Eine momentane Erhöhung (s.u.) der Ca2+-Konzentration (Calcium) im Sarkoplasma von ca. 10–8 auf 10–5 mol/l führt zur allosterischen Umlagerung (Allosterie) der Troponin-Tropomyosin-Komplexe am Actinfilament und gibt die Myosin-Bindestellen am Actin frei, aktiviert damit also indirekt die Myosin-ATPase, die dann als Actomyosin-ATPase das aktive Enzym bildet (elektromechanische Koppelung). Dieses benötigt als Cofaktor Mg2+ (Magnesium). Unter Hydrolyse von ATP zu ADP + Pi (Adenosin-5'-diphosphat; Adenosintriphosphat [Abb.]) kann nun jeder Myosinkopf eine Bindung mit dem nächstgelegenen Actin eingehen, wobei die „Vorspannungsenergie“ des Myosins in kinetische Energie umgewandelt wird, so daß die Myosinmoleküle in ihre energieärmere, stärker abgewinkelte Konformation zurückschnellen und die gebundenen Actinfilamente um einen Betrag von etwa 10 nm an sich entlangziehen. Eine erneute Bindung von ATP löst die Actomyosin-Komplexe (Actomyosin) wieder und bereitet den nächsten Kontraktionszyklus vor. Bisherige Annahmen, nach denen bei jeder Acto-Myosin-Bindung pro Kontraktionszyklus 1 ATP verbraucht wird, erwiesen sich in jüngster Zeit als unwahrscheinlich. Neuere exaktere Messungen an Wechselwirkungen zwischen Einzelmolekülen lassen vermuten, daß die Energie eines ATP-Moleküls an den Myosinköpfen auf eine bis jetzt unbekannte Art gespeichert und schrittweise verbraucht werden kann, wobei nicht jeder Kontraktionszyklus seinen gesamten Energiebedarf allein aus der ATP-Hydrolyse deckt sondern zusätzlich die Oszillationen der Myosinköpfe aufgrund ihrer Wärmebewegung in dem Maße zu nutzen in der Lage ist, in dem diese zufällig in der richtigen Richtung erfolgen. Die Zyklen folgen aufeinander, solange genügend ATP im Muskel zur Verfügung steht, und sie werden gesteuert durch kurzfristig wechselnde Ca2+-Konzentrationen im Sarkoplasma. Im Ruhezustand bleibt das Calcium in den Zisternen des sarkoplasmatischen Reticulums (L-System) gespeichert. Seine Freigabe erfolgt auf nervösen Reiz hin (Calciumkanäle). Auf die Muskelmembran (Myolemm) auftreffende motorische Nervenimpulse (motorische Endplatte) pflanzen sich als Depolarisationswelle (Depolarisation) bis in die Tiefen der T-Tubuli (T-System, Transversalsystem) fort. An den gap-junction-artigen Berührungsstellen (gap-junctions) zwischen T- und L-System springen sie auf das letztere über und lösen dort durch eine kurzfristige Permeabilitätsänderung (Permeabilität) einen Calcium-Ausstrom aus. Unmittelbar nach Abklingen des nervösen Impulses befördern Calcium-Pumpen in den Membranen des L-Systems das Ca2+ in die L-Zisternen zurück bis zur Auslösung des nächsten Zyklus. – Innerhalb des einzelnen Sarkomers laufen die einzelnen Actin-Myosin-Interaktionen nicht synchron ab, sondern in metachronen Wellen wie etwa die Beinbewegungen eines Tausendfüßers. Wenngleich der einzelne Actomyosin-Zyklus nur etwa 1/100 Sekunde dauert, ist die Kontraktionsfrequenz der gesamten Muskelfaser oder gar eines Muskels doch in der Regel wesentlich niedriger. Sie ist für verschiedene Muskeltypen unterschiedlich und hängt von den beteiligten Myosintypen (Myosin), der Struktur des T- und L-Systems in der einzelnen Muskelfaser, der Repolarisations- und Pumpgeschwindigkeit der beteiligten Membranen, von der Innervation und schließlich auch der Art der Energiebereitstellung (Glykolyse oder Atmung, s.u.) ab. Überschreitung der Aktionsfrequenz durch zu rasch aufeinanderfolgende Erregungsimpulse (Aktionspotential, Erregung) führt zur energieaufwendigen Dauerkontraktion (Tetanus, Krampf) des einzelnen Muskels. – Wenngleich auch die Kontraktion glatter Muskelzellen (glatte Muskulatur) und durch Acto-Myosin-Wechselwirkungen erzeugte Plasmabewegungen in Nichtmuskelzellen nach dem gleichen Prinzip erfolgen, so fehlt dort das Ca2+-abhängige Tropomyosin-Troponin-Steuersystem. Doch wirken auch hier – allerdings mittelbar – Ca2+-Ionen als Regulatoren, indem sie an Calmodulin gebunden eine spezifische Kinase aktivieren. Diese ihrerseits ermöglicht dann durch Phosphorylierung einer der leichten Ketten im Myosinkopf dessen Bindung an Actin. Die Energie für die Muskelkontraktionen wird in rasch arbeitenden, allerdings auch rasch ermüdenden (weißen) Muskelfasern (Ermüdung, weiße Muskeln) hauptsächlich durch Glykolyse von Kohlenhydraten zu Lactat (Milchsäure) bereitgestellt, in den weniger rasch arbeitenden, dafür aber dauerbelastbaren, an Myoglobin reichen (roten) Muskelfasern (rote Muskeln) jedoch auf aerobem Wege aus oxidativer Phosphorylierung (Atmungskettenphosphorylierung) gewonnen. Die Verarmung von Muskelfasern an ATP nach Überlastung führt zur vorübergehenden Bildung fester Actomyosin-Komplexe und läßt die betreffenden Fasern erstarren (Muskelkater), was beim völligen Erlöschen der ATP-Produktion nach dem Tod der Zelle die Leichenstarre bewirkt. – Man unterscheidet in der Physiologie zweierlei Arten von Muskelkontraktionen ( vgl. Abb. ), eine sog. isotonische Kontraktion, wie sie bei Fortschreiten der Muskelverkürzung unter gleichbleibendem Kraftaufwand vor sich geht, und eine isometrische Kontraktion, die bei konstanter Muskellänge und tetanischer Kontraktion dann auftritt, wenn die Muskelspannung im Gleichgewicht steht mit einem unüberwindbar hohen Widerstand, der eine Verkürzung verhindert. Eine Sonderform der Muskeldauerkontraktion bei minimalem Energieverbrauch ist von manchen Wirbellosen-Muskeln, z.B. den Schließmuskeln mancher Muscheln (sog. Paramyosin-Catch- oder Sperrmuskeln) bekannt. Ihre Myosinfilamente bestehen zu einem beträchtlichen Anteil aus dem Begleitprotein Paramyosin, das auf eine bis jetzt noch unbekannte Weise die Lösung von Actin-Myosin-Bindungen regulieren und so einen Muskel in einem Dauertonus ohne weiteren Energieverbrauch „einfrieren“ kann. Ca2+-Ionen zur Regulierung von Myosin-ATPase und Actin-Bindefähigkeit werden in diesen Muskeln unmittelbar von einer der leichten Ketten des Myosinkopfes gebunden. – Der sliding-filament-Mechanismus wurde 1954 von dem engl. Anatomen H.E. Huxley zusammen mit J. Hanson, die Kontraktionssteuerung vor allem von seinem Vetter A.F. Huxley zusammen mit R. Niedergehrke aufgeklärt. Biomechanik, Biophysik, Elektromyogramm, Embden (G.), Hermann (L.), Hill (A.V.), Ionenkanäle, Kontraktur, Muskelreflex, Muskelrelaxantien, Muskelspindeln, Myosin-Leichtketten-Kinase, Myosin-Leichtketten-Phosphatase, Synchronisation, Szent-Györgyi (A.); Muskelkontraktion I
Muskelkontraktion II
, Regelung im Organismus.
P.E.
Muskelkontraktion
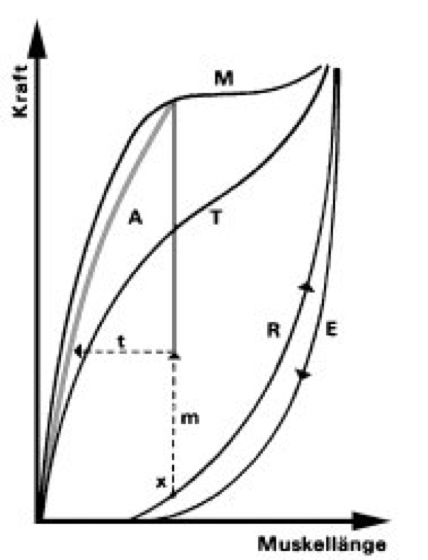
Die mechanischen Eigenschaften des quergestreiften Muskels lassen sich an dem Arbeitsdiagramm ablesen. Die Verlängerung des Muskels bei Belastung wird durch die Ruhedehnungskurve R, die Kontraktion nach Entfernen der Last durch die Entdehnungskurve E wiedergegeben. Bei tetanischer Kontraktion erfolgt zunächst die isometrische Phase m (Spannungsentwicklung ohne Verkürzung), dann die isotonische Phase t (Verkürzung bei konstanter Spannung). Die verschiedenen Kontraktionen bei gegebenem Ausgangszustand (x) liegen auf der Arbeitskurve A. Sie liegt zwischen den Grenzwertkurven für vorwiegend isotonische Kontraktion T (Verkürzung gegen frei hängendes Gewicht) und für vorwiegend isometrische Kontraktion M (Kraftanstieg bei Last > Muskelkraft).
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.