Lexikon der Biologie: Transkription
Transkription w [von latein. transcriptio = Umschrift; Verb transkribieren], RNA-Synthese, RNS-Synthese, der 1. Schritt der Genexpression, bei dem es, von bestimmten RNA-Viren abgesehen, zu einer DNA-abhängigen (Desoxyribonucleinsäure fungiert als Matrize) Synthese der Ribonucleinsäuren kommt, die durch DNA-abhängige RNA-Polymerase katalysiert wird und zur Bildung von messenger-RNA (mRNA), transfer-RNA (tRNA), ribosomaler RNA (rRNA; vgl. Abb. 1 ) und einer Reihe weiterer RNA-Spezies führt. Die Transkription ähnelt der DNA-Replikation dahingehend, daß eine matrizenabhängige Synthese von Nucleinsäuren aus Nucleosidtriphosphaten (2'-Desoxyribonucleosid-5'-triphosphate, Ribonucleosid-5'-triphosphate) erfolgt. Sie unterscheidet sich von dieser aber auch in wesentlichen Merkmalen: Bei der Transkription wird nur ein DNA-Strang (Matrizenstrang, codogener Strang) und von diesem nur ein kleiner Teil in RNA umgeschrieben. Hinzu kommt, daß RNA-Polymerasen die Fähigkeit zum sog. proof-reading (DNA-Polymerasen) fehlt. Bei der Transkription werden als energiereiche Vorstufen bzw. Substrate die 4 Ribonucleosid-5'-triphosphate ATP (Adenosintriphosphat), CTP (Cytidintriphosphat), GTP (Guanosin-5'-triphosphat) und UTP (Uridin-5'-triphosphat) umgesetzt und sukzessive in Form der Ribonucleosidmonophosphate dieser Vorstufen in die vom 5'- zum 3'-Ende hin schrittweise wachsenden RNA-Ketten eingebaut. Auf diese Weise werden die Nucleotidsequenzen der Gene (DNA) in Form einzelner RNA-Ketten kopiert, d.h. von DNA zu RNA „umgeschrieben“ – daher die Bezeichnung Transkription. Die Transkription stellt den ersten Teilschritt bei der Ausprägung der in DNA verschlüsselten genetischen Information (Genexpression) dar und vollzieht sich in den 3 Phasen Initiation (Kettenstart), Elongation (Kettenverlängerung) und Termination (Kettenabbruch oder -abschluß). Vor allem für Initiation und Termination sind neben der RNA-Polymerase meist zusätzliche Proteine erforderlich. Dies sind bei Prokaryoten z.B. das cAMP bindende Protein und Sigma-Faktoren zur Initiation und der rho-Faktor (Rho-Protein) zur Termination ( vgl. Abb. 2 ). Die Elongation wird z.B. durch das Nus-A-Protein beeinflußt. Bei Eukaryoten vermittelt eine Vielzahl von Transkriptionsfaktoren insbesondere die Initiation der Transkription, wobei die Bindung dieser Faktoren an die regulatorischen Sequenzen von Genen wesentlich von der lokalen Chromatinorganisation (Eu- und Hetero-Chromatin) bzw. der Anordnung der Nucleosomen sowie der DNA-Methylierung mitbestimmt wird. Regulatorische Sequenzen auf der DNA, die den Initiationspunkt und die Initiationshäufigkeit festlegen, sind die Promotoren. Durch Bindung der generellen Transkriptionsfaktoren am Promotor bildet sich der Präinitiationskomplex; mit Bindung der RNA-Polymerase und eines Nucleosidtriphosphats spricht man vom Initiationskomplex. Die Häufigkeit der Transkription einzelner Gene bzw. Gengruppen sowie die Effizienz der Transkription wird durch eine Vielfalt von Signalstrukturen reguliert. Bei eukaryotischen und viralen Genen (Viren) kann die Transkription z.B. durch sog. enhancer verstärkt werden – DNA-Abschnitte, die an nahezu beliebigen Positionen (bis zu mehreren kb [= Kilobasen; Kilobasenpaare] vor, aber auch innerhalb oder hinter der codierenden DNA-Region) und in beliebiger Orientierung bezüglich des betreffenden Gens vorkommen können. Sog. silencer im flankierenden Bereich eukaryotischer und viraler Gene reduzieren die Häufigkeit der Initiation. Die den Kettenabschluß vermittelnden Signalstrukturen werden als Terminatoren bezeichnet (weitere Informationen zur Transkriptionskontrolle: differentielle Genexpression, Genregulation, Response-Element; Antitermination, Attenuatorregulation, transkriptionelle Antitermination). – Die Transkription verläuft in einem Komplex aus DNA, RNA und RNA-Polymerase, den man aufgrund seiner elektronenmikroskopisch auffälligen Struktur Transkriptionsblase nennt ( vgl. Abb. 3 ). Produkte der Transkription sind einzelsträngige RNA-Ketten, die zum codogenen Strang der DNA-Matrize komplementär sind bzw. in der Nucleotidsequenz mit dem nichtcodogenen DNA-Strang identisch sind (aber: Uracil anstelle von Thymin und Ribose an Stelle von Desoxyribose). Im Rahmen der Prozessierung werden die Primärtranskripte zu den reifen, meist kürzerkettigen RNAs (mRNAs, rRNAs oder tRNAs) umgewandelt, bei sog. Mosaikgenen (Genmosaikstruktur) ist dieser Vorgang mit dem Spleißen identisch. Eukaryotische mRNAs werden außerdem durch Capping am 5´-Ende und durch Polyadenylierung am 3´-Ende modifiziert. Bei Prokaryoten erfolgt die Transkription benachbarter Gene häufig in Form einer einzigen RNA-Kette (polycistronische mRNA), wie z.B. bei den Genen des Arabinose-Operons, des Galactose-Operons und des Lactose-Operons. Zudem findet meist gleichzeitig mit der Transkription die Translation (cotranskriptionale Translation) statt. Bei Eukaryoten ist die Transkription der nucleären Gene wegen der hier vorliegenden Kompartimentierung räumlich und zeitlich von der im Cytoplasma stattfindenden Translation getrennt. Die gebildeten Primärtranskripte (hn-RNA) werden nach der Prozessierung im Zellkern durch den Kernporenkomplex in das Cytoplasma transportiert. In Mitochondrien findet die Transkription an beiden Strängen der mtDNA (mitochondriale DNA) statt. Die Transkripte entsprechen der kompletten Sequenz je eines der beiden mtDNA-Stränge und werden noch während der Transkription durch RNasen (Ribonucleasen) in die einzelnen tRNAs, rRNAs und mRNAs zerschnitten (mitochondriale RNA). Ähnlich verläuft die Transkription in Plastiden. Viele Gene des Plastoms sind wie bei Prokaryoten polycistronisch organisiert. Einige Gene zeigen eine für Eukaryoten typische (und auch im mitochondrialen Genom gefundene) Genmosaikstruktur, wobei Exonen weit auseinander und auf unterschiedlichen DNA-Strängen lokalisiert sein können und durch trans-Spleißen miteinander verbunden werden müssen. – Verschiedene Wirkstoffe vermögen die Transkription sehr spezifisch zu inhibieren, z.B. durch Interkalation in die doppelsträngige Matrizen-DNA (Actinomycine), durch Blockierung der RNA-Polymerase (Rifampicin bei Prokaryoten, Amatoxine bei Eukaryoten) oder durch Verhinderung der Kettenverlängerung (Cordycepin), und sind damit für analytische und therapeutische Zwecke von Interesse. – Methoden zur Analyse der Transkription bzw. der RNA-Transkripte sind u.a. in-vitro-Transkription, in-vivo-Analyse mittels Reportergenen, Northern-Technik (blotting-Techniken), Nuclear-run-on-Transkription, primer-extension-Analyse, RNase-Schutzexperimente, RT-PCR (Polymerase-Kettenreaktion), run-off-Transkription, S1-Kartierung. – Gegensatz: reverse Transkription (reverse Transkriptase). Biochemie (Geschichte der), Genaktivierung, RNA-Editing, transkriptionelle Antitermination, Transkriptionssystem, Transkriptom. – Transkription – Translation .
H.K./E.G./M.B.
Transkription
Zwischen der Transkription prokaryotischer (Protocyte) und eukaryotischer Zellen (Eucyte) bestehen, was die biochemischen Grundlagen der RNA-Synthese anbelangt, generell keine Unterschiede. Jedoch sind an der Transkription bei beiden Zelltypen verschiedene Strukturen und Proteinfaktoren auf unterschiedliche Weise wirksam. So kommt z.B. bei Eukaryoten mehr als 1 RNA-Polymerase vor, so daß die verschiedenen RNA-Spezies durch unterschiedliche Enzyme synthetisiert werden. Hinzu kommt, daß die Verpackung eukaryotischer DNA in Chromosomen die Transkription beeinflußt. Allgemein läßt sich die Transkription in 3 Teilschritte unterteilen, die Initiation („Kettenstart“), bei der es zur Wechselwirkung des zu transkribierenden Gens mit der RNA-Polymerase kommt, die Elongation („Kettenverlängerung“) als Phase der RNA-Synthese und die Termination („Kettenabbruch“), die zur Beendigung der Transkriptionsprozesse und Freigabe der RNA führt.
– Initiation: Zu Beginn der Transkription kommt es zu einer Erkennung bestimmter Sequenzmotive im Promotor eines Gens durch die RNA-Polymerase. Sie wird durch gerichtete Diffusion der RNA-Polymerase entlang der DNA-Doppelhelix möglich, wobei elektrostatische Wechselwirkungen (schwache Wechselwirkungen) sowie Interaktionen des Enzyms mit Wasserstoffdonoren und -akzeptoren der DNA auftreten. Bei Prokaryoten erfolgt die spezifische Erkennung mittels des sog. Sigma-Faktors, bei eukaryotischen Zellen wird diese durch Transkriptionsfaktoren wie z.B. TBP (= TATA-Box bindendes Protein, TATA-Bindeprotein) vermittelt. Der Sigma-Faktor ist Bestandteil des bakteriellen RNA-Polymerase-Holoenzyms und erkennt spezifische Motive in der doppelsträngigen DNA. Bei diesen handelt es sich um Sequenzen, die als Minus-10-Box (Pribnow-Box) und Minus-35-Box bezeichnet werden, da sie 10 bzw. 35 Nucleotide stromaufwärts (upstream) vom Transkriptionsstart, der das erste Nucleotid der RNA darstellt, lokalisiert sind. Im Anschluß an diese Prozesse deckt die RNA-Polymerase einen Bereich von –50 bis +20 Basenpaaren ab. Dieser sog. geschlossene Komplex wird abschließend durch partielles Entwinden der DNA in den offenen Komplex überführt. Nach erfolgter Initiation dissoziiert der Sigma-Faktor von der RNA-Polymerase, die eine Konformationsänderung durchläuft und mit der RNA-Synthese beginnt.
– Elongation: In dieser Phase bewegt sich die RNA-Polymerase in 5'-3'-Richtung (des codierenden Strangs)an der DNA entlang, wobei es am Matrizenstrang (codogener Strang) zur RNA-Synthese in 5'-3'-Richtung kommt. Innerhalb des DNA-RNA-Proteinkomplexes, der Transkriptionsblase, kommt es vor dem 3'-Ende der entstehenden RNA zu einer Entwindung von jeweils 17 Basenpaaren der DNA, der eine Verdrillung folgt, nachdem die RNA-Polymerase einen DNA-Abschnitt abgelesen hat. Durch die wiederentstehende Doppelhelix wird die RNA aus der zunächst entstandenen DNA-RNA-Helix verdrängt.
– Termination: Die Transkription erfolgt so lange, bis die RNA-Polymerase auf eine Terminatorsequenz stößt, an der es zum Anhalten der RNA-Synthese kommt und sich die RNA und das Enzym vom Komplex lösen. Bei Prokaryoten sind 2 verschiedene Arten der Termination bekannt, die sich darin unterscheiden, ob an ihr der Rho-Faktor (Rho-Protein) beteiligt ist oder nicht. Bei der Rho-unabhängigen Termination verursacht ein GC-reicher Bereich die Entstehung einer Haarnadelstruktur (engl. hairpin loop; Haarnadelschleifen; vgl. Abb. 4 ) in der RNA, wobei angenommen wird, daß sich die Transkriptionsrate aufgrund einer langsameren Entwindung der GC-reichen Sequenz ebenfalls verlangsamt und die Bildung der Haarnadelstruktur fördert. An den GC-reichen Bereich schließt sich stets eine aus 6 Nucleotiden bestehende poly(A)-Sequenz an. Die auf Ebene der RNA vorhandene poly(U)-Sequenz bildet mit der poly(A)-Sequenz der DNA nur relativ schwache Wechselwirkungen, so daß es schließlich zu einem Lösen der RNA vom Matrizenstrang und somit zur Beendigung der Transkription kommt. Bei der Rho-abhängigen Termination bindet der Rho-Faktor zunächst an die entstehende RNA und bewegt sich durch ATP-Hydrolyse (Adenosintriphosphat) auf der RNA entlang zur Polymerase, wo es zur Entwindung der DNA-RNA-Helix und letztlich zur Auflösung der Transkriptionsblase kommt.
Bei Eukaryoten erfolgt die Termination der Transkription analog zur faktorenunabhängigen Termination. Im Unterschied zu detaillierten Kenntnissen über die Struktur eukaryotischer Promotoren und Transkriptionsfaktoren liegen über eukaryotische Terminatoren weniger Informationen vor.
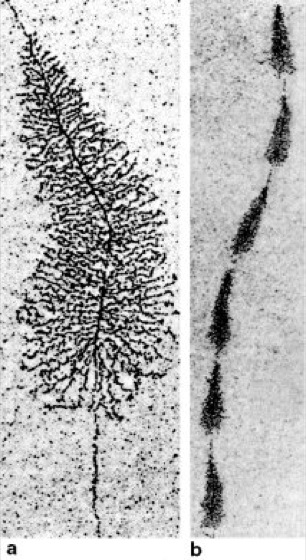
Transkription
Abb. 1: Die elektronenmikroskopischen Aufnahmen zeigen einen Transkriptionsvorgang: die Synthese von ribosomaler RNA (rRNA) entlang einem Gen für ribosomale RNA. Viele RNA-Polymerasen hintereinander synthetisieren die rRNA entlang der zentralen DNA vom Startsignal (in Abb. a oben) bis zum Stopsignal (in Abb. a unten), wo die RNA-Moleküle ihre volle Länge erreichen und freigesetzt werden (a, stärkere Vergrößerung). Bei vielen Organismen enthält die DNA gleich eine ganze Serie von Genen für die rRNA (b, geringere Vergrößerung).
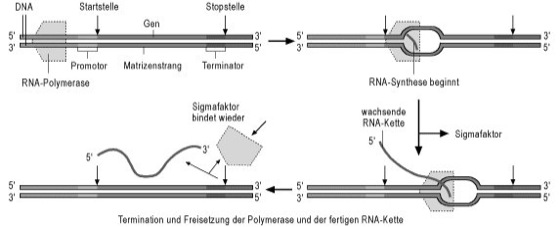
Transkription
Abb. 2: Schema der Transkription bei Prokaryoten
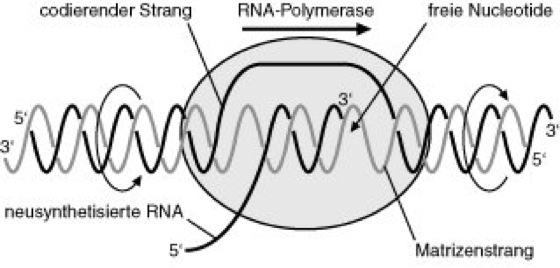
Transkription
Abb. 3: Der Komplex aus DNA, RNA und RNA-Polymerase bildet die Transkriptionsblase. Im vorderen Bereich der Transkriptionsblase wird die DNA-Doppelhelix entwunden und aufgebrochen, im hinteren Bereich wird die neusynthetisierte RNA aus der Bindung an den Matrizenstrang verdrängt und die DNA-Doppelhelix rückgebildet. Dazwischen bildet sich ein RNA/DNA-Hybrid, wobei die RNA-Polymerase die Basenpaarung des Matrizenstrang-Codons mit dem eintretenden Ribonucleotid kontrolliert und die Phosphodiesterbindung knüpft.

Transkription
Abb. 4: Haarnadelförmige Sekundärstruktur im 3'-nichtcodierenden Bereich einer prokaryotischen mRNA. Links ist ein Stopcodon für die Translation (UAA) zu erkennen, rechts im Anschluß an den GC-reichen Bereich der Haarnadelstruktur eine poly(U)-Sequenz. Diese Sequenz bildet mit der poly(A)-Sequenz der DNA relativ schwache Wechselwirkungen, was das Lösen der RNA vom Matrizenstrang bewirkt.
Schreiben Sie uns!