Lexikon der Biologie: Actin
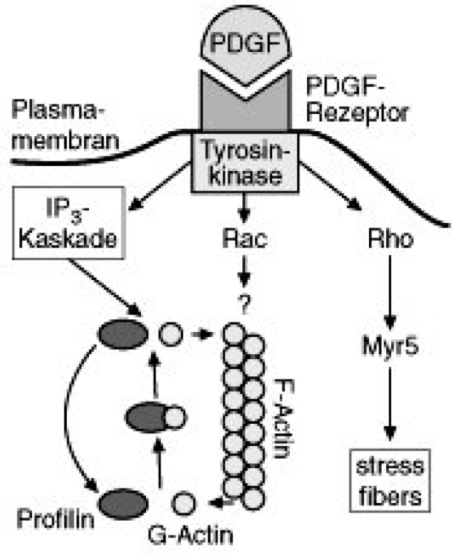
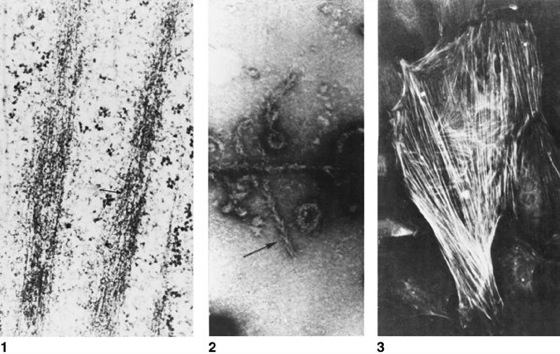
Actin s [von latein. actio = das In-Bewegung-Setzen], Aktin, Strukturprotein, das in allen eukaryotischen Zellen (Eucyte, Zelle) am Aufbau des Zellskeletts und von Haftstrukturen, an der Signalübertragung (Signaltransduktion) durch Zellmembranen (Membran) sowie an der Erzeugung verschiedener Formen von Zellbewegung (Bewegung) beteiligt ist und einen bedeutenden Anteil am zellulären Gesamtprotein ausmacht (in Leberzellen 1–2%, in amöboid beweglichen Zellen bis zu 17%, in Säugermuskeln bis zu 25%). Bei Prokaryoten fehlt Actin generell. – Actin wird als monomeres G-Actin (globuläres Actin) synthetisiert und besteht aus einer einzigen Polypeptidkette mit einer relativen Molekülmasse von 40 000–45 000 (je nach Spezies und Actin). Die G-Actin-Monomere zeigen eine deutliche Polarität. An ihrer Plus-Seite vermögen sie 1 Ca2+-Ion, ATP (Adenosintriphosphat) oder ADP (Adenosin-5´-diphosphat) mit hoher Affinität zu binden. Bei Anwesenheit von K+- oder Mg2+-Ionen polymerisieren die Monomere in vitro spontan unter Hydrolyse von ATP zu perlschnurartigen Ketten aus F-Actin (filamentäres Actin). Pro angefügtem Molekül G-Actin wird 1 Molekül ATP zu ADP und Pi (Pi = anorganisches Phosphat) hydrolysiert. Das dabei entstehende ADP bleibt an die G-Actin-Untereinheit in der F-Actin-Kette gebunden. In der Regel winden sich dann 2 derartige Ketten zu einem Doppelfilament (Actinfilament) umeinander. Unter den physiologischen Bedingungen der Zelle wird der Grad der Polymerisation und Depolymerisation des Actins durch eine Reihe Actin-bindender Proteine gesteuert. – Actin wurde erstmals 1942 von F.B. Straub im Labor von A. Szent-Györgyi (Szeged) aus einer Myosin B-Fraktion (Actomyosin) der Kaninchen-Skelettmuskulatur isoliert und als eigenes Protein beschrieben. Heute weiß man, daß die Actine eine ganze Familie sehr konservativer, in ihren Eigenschaften (Polymerisation, Wechselwirkung mit Hilfsproteinen, ATP- und Myosinbindung) überaus einheitlicher Proteine darstellen. Entsprechend ihren Funktionen in der Zelle unterteilt man sie in 2 Gruppen: die namentlich am Aufbau des Muskulatur (Myofibrillen) beteiligten α-Actine und die cytoplasmatischen β-Actine und γ-Actine. In den meisten Organismen und Zelltypen werden mehrere dieser Actine gleichzeitig ausgebildet, codiert durch eine ganze Familie von Actingenen (Multigenfamilie), die durch Genduplikation auseinander hervorgegangen sind. Bei Säugern kennt man deren 6, bei dem amöboid kriechenden Schleimpilz Dictyostelium sogar 17 verschiedene Actingene. – In pflanzlichen wie tierischen Zellen sind Actine, gewöhnlich in Zusammenwirkung mit Myosinen (Myosin, sliding-filament-Mechanismus; vgl. Abb. ), entscheidend an der Erzeugung intrazellulärer Bewegungsvorgänge beteiligt, wie Plasmaströmung und amöboider Bewegung. Zudem spielen sie bei der Bildung von Kontaktstrukturen zwischen Zellen (junctions) und bei der Adhäsion an Substrate (Adhäsine, Zelladhäsion) eine wichtige Rolle. Die Steuerung der Actindynamik durch Signalketten wurde an Fibroblasten genauer untersucht ( vgl. Abb. ). Hier werden durch rezeptorvermittelte Signalwege (angeregt z. B. durch den platelet-derived growth factor; PDGF) innerhalb von 30 Minuten 2 mit der Chemotaxis zusammenhängende Reaktionen des Actinskeletts aktiviert: 1) die Ausbildung von Lamellipodien (Pseudopodien) in Richtung des Signals (sog. ruffling), wobei Actin am Außensaum des Lamellipodiums polymerisiert, an dessen Basis jedoch abgebaut wird (treadmilling); 2) die Bildung langer Actinbündel von der Zellmitte in Bewegungsrichtung, die für Adhäsion und Zusammenhalt der Fibroblasten wichtig sind (sog. stress fibers). Die einzelnen Schritte der entsprechenden Signalübertragungswege werden durch kleine GTPasen (Guanosintriphosphatasen), wie Rho, Ras und Rac, ausgelöst. Rho steht in Wechselwirkung mit einem Myosin und steuert so die Bildung der stress fibers. Parallel wird über die Inositol-3-phosphat-Kaskade die Bindung des Actin-bindenden Proteins Profilin an G-Actin gelöst und so die Polymerisation von G-Actin zu F-Actin freigegeben. Dies gilt als entscheidender Schritt für die chemotaktische Ausrichtung der Lamellipodien amöboider Zellen. Actin kann jedoch auch selbst als Glied der Signaltransduktion wirken: Die Wanderung des Glucocorticoidrezeptors in den Kern wird über eine durch ein Hitzeschockprotein 90 vermittelte Verankerung an Actin unterbunden. Nach Gabe von Steroidhormonen löst sich diese Bindung, und der Rezeptor wandert an seinen Wirkort in den Kern. In ihrer am leichtesten durchschaubaren Anordnung liegen Filamente aus α-Actin in den Myofibrillen von Muskelzellen vor, besonders in quergestreifter Muskulatur. Zusammen mit Myosinfilamenten (Myosinfilament) bilden sie den Motor der Muskelkontraktion und machen als Actomyosin-Komplexe bis zu 80% des muskulären Gesamtproteins aus. – In Pflanzenzellen erfüllen Actine noch eine Vielfalt weiterer Funktionen. So wird die Durchlässigkeit der Plasmodesmen über Actin gesteuert, durch Zerstörung der Actinfilamente mit Cytochalasin D (Cytochalasane) werden die Plasmodesmen auch für größere Proteine durchlässig. Darüber hinaus ist Actin für die Festlegung der Zellteilungsachse wichtig. Hierfür haben Pflanzen eine spezielle Actinstruktur, das sog. Phragmosom (Phragmosomen), entwickelt, das für die Zellteilung wichtige Mikrotubulistrukturen (Präprophaseband und Phragmoplast; Mikrotubuli) organisiert. Actinfilamente spielen auch bei der auxinabhängigen Zellstreckung eine Rolle. Zum einen ist der Efflux-Carrier des Pflanzenhormons Auxin wahrscheinlich an Actin gebunden, zum anderen geht die wachstumshemmende Wirkung von Aluminium zumindest teilweise auf eine Bündelung und Versteifung der Actinfilamente zurück. Auch für die Abwehrreaktion pflanzlicher Zellen gegen Pilzbefall ist Actin notwendig (pflanzliche Abwehr). Nach Zerstörung der Actinfilamente durch Cytochalasin D können verschiedene Getreidesorten von Pilzen befallen werden, gegen die sie an sich resistent sind. Andererseits benutzen einige Pflanzenviren das Actingerüst der Wirtszelle, um sich dadurch über die Plasmodesmen von Zelle zu Zelle fortzubewegen und sich auf diese Weise in der Pflanze auszubreiten. Chromosomenkarte ( Chromosomenkarte I
Chromosomenkarte II
Chromosomenkarte III
Chromosomenkarte IV
), Leben, Membranskelett, Mikrovilli, Motorproteine, Muskelkontraktion (Farbtafel II), Muskulatur (Farbtafel).
P.E./P.N.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.