Lexikon der Biochemie: Aminosäuren
Aminosäuren, organische Säuren, die mindestens eine und gewöhnlich nicht mehr als zwei Aminogruppen besitzen. Je nach der Stellung der NH2-Gruppe in der Kohlenstoffkette zu der endständigen Carboxylgrupppe -COOH unterscheidet man α-, β-, γ-A., usw (Abb. 1).
Die α-A. kommen in freier Form in allen lebenden Zellen und in Körperflüssigkeiten vor. Sie sind die Bausteine der Proteine und Peptide. Die mRNA (Proteinbiosynthese, genetischer Code) codiert für die 20 A., die in Proteinen vorkommen. Diese werden als proteinogene A. bezeichnet (Tab. 1). Das Vorkommen nichtproteinogener A. in Proteinen ist auf posttranslationelle Modifizierung dieser Proteine zurückzuführen (Tab 2).
A. werden in Abhängigkeit von ihrem isoelektrischen Punkt entweder als sauer oder als basisch klassifiziert. Alternativ dazu werden die A. entsprechend dem Charakter ihrer Seitenketten in vier Gruppen eingeteilt, die mit den römischen Zahlen I bis IV bezeichnet werden:
I. A. mit neutralen und hydrophoben (unpolaren) Seitenketten.
II. A. mit neutralen und hydrophilen (polaren) Seitenketten.
III. A. mit sauren und hydrophilen (polaren) Seitenketten.
IV. A. mit basischen und hydrophilen (polaren) Seitenketten.
Zusätzlich zu dieser chemischen Klassifikation, können die A. entsprechend ihres Abbaus im Organismus in glucogene und ketogene A. eingeteilt werden. Glucogene A. werden zu C4-Dicarbonsäuren oder Pyruvat abgebaut, welche Zwischenprodukte des Tricarbonsäure-Zyklus sind. Dieser Zyklus stellt Oxalacetat für die Gluconeogenese zur Verfügung, so dass die Kohlenstoffgruppe der A. dieser Gruppe in Glucose inkorporiert werden kann. Ketogene A. werden zu Ketonen, insbesondere Acetessigsäure abgebaut. Schließlich unterscheidet man zwischen essenziellen (unentbehrlichen) und nichtessenziellen (entbehrlichen) A., je nachdem ob der betreffende Organismus in der Lage ist, diese entsprechend seinem Bedarf in ausreichender Menge zu synthetisieren. Essenzielle A. müssen dem Organismus mit der Nahrung zugeführt werden, da eine unzureichende Zuführung eine negative Stickstoffbilanz zur Folge hat. Halbessenzielle A. können zwar synthetisiert werden, stehen aber nicht für alle physiologischen Bedürfnisse in ausreichender Menge zur Verfügung. Wenn nur eine einzige essenzielle Aminosäure nicht ausreichend über die Nahrung zugeführt wird, hat dies eine Inhibierung der Proteinbiosynthese zur Folge. Der Komplex aus Ribosom, mRNA und entstehender Polypeptidkette muss seine Arbeit an dem Punkt einstellen, an dem die fehlende Aminosäure eingebaut werden sollte. Die anderen A. reichern sich an und werden metabolischen Abbauwegen zugeführt. Dies führt zu einem Stickstoffverlust (Tab. 3).
Außer Glycin besitzen alle A. mindestens ein chirales C-Atom. Mit wenigen Ausnahmen haben natürlich vorkommende A. die L-Konfiguration. D-A. kommen in den Zellwänden, Kapseln, in Kulturlösungen einiger Mikroorganismen und in vielen Antibiotika vor. A. ohne eine α-Aminogruppe (β-, γ-, δ-A., z.B. β-Alanin) kommen als freie Säuren oder als Bestandteile organischer Produkte vor, nicht aber in Proteinen.
A. sind aufgrund des Vorliegens einer NH2- und einer COOH-Gruppe in demselben Molekül amphoter, ihre Lösungen sind Ampholyte. Im festen Zustand und in stark polaren Lösungsmitteln liegen die A. in der Zwitterionenform H3N+-CHR-COO- vor Abb. 1). Sie lösen sich mit wenigen Ausnahmen in Wasser, Ammoniak und anderen polaren Lösungsmitteln gut, dagegen in unpolaren und wenig polaren Lösungsmitteln, z.B. Ethanol, Methanol und Aceton, sehr schwer. A. mit hydrophilen Seitenketten weisen eine bessere Löslichkeit in Wasser auf. Am isoelektrischen Punkt ist die Wasserlöslichkeit der meisten A. am geringsten, da durch die dominierende Zwitterionenstruktur die Hydrophilie der Amino- und Carboxylgruppe aufgehoben ist. Das Dissoziationsverhalten der A. ist stark vom pH-Wert abhängig, wobei nur im pH-Bereich vier bis neun die Zwitterionenform vorliegt. Im stärker sauren Bereich liegen die A. als Kationen (H3N+-CHR-COOH), im stärker alkalischen Bereich als Anionen (H2N-CHR-COO-) vor. Die Titrationskurven der A. zeigen demzufolge zwei verschiedene Pufferbereiche, die durch das Dissoziationsverhalten besonders auch der sauren und basischen Seitenkettenfunktionen gekennzeichnet ist (Abb. 2 und Abb. 3). Das Säure-Base-Verhalten der A. dient als Modell für das Verhalten der Peptide und Proteine und ist Grundlage für die analytische Trennung durch Elektrophorese und Ionenaustauschchromatographie. Die UV-Absorption der A. mit chromophoren Seitenkettenfunktionen (Tryptophan, Tyrosin, Phenylalanin) ermöglicht die quantitative Bestimmung dieser A., sowohl in freier als auch in gebundener Form (in Peptiden und Proteinen).
Die proteinogenen A. können nach der Herkunft ihres Kohlenstoffgerüsts in der Biosynthese in Familien eingeteilt werden:
1) Die Serinfamilie umfasst die A. Serin, Glycin, Cystein und Cystin, die sich aus Triosephosphat herleiten. 2) Die Ketoglutarat- bzw. Oxoglutaratfamilie enthält diejenigen A., deren Kohlenstoffskelett sich vom Oxoglutarat des Tricarbonsäure-Zyklus ableitet: Glutamat, Glutamin, Ornithin, Citrullin, Arginin (Harnstoff-Zyklus), Prolin und Hydroxyprolin. 3) Die Pyruvatfamilie stammt von Pyruvat und Oxalacetat ab (Abb. 4). Die Pentosefamilie schließt Histidin und die drei aromatischen A. (Aromatenbiosynthese) Phenylalanin, Tyrosin und Tryptophan ein.
Die mikrobielle Synthese von A. wird industriell genutzt, indem spezielle Produktionsstämme von Mikroorganismen (meistens Bakterien) in einem synthetischen Medium kultiviert werden. In diesen Kulturstämmen ist die metabolische Kontrolle durch Mutation beeinträchtigt, was zu einer massiven Überproduktion einer bestimmten Aminosäure führt. Die ausgeschiedene Aminosäure wird aus dem Medium geerntet.
Der Aminosäurepool (bzw. die -pools bei Vorliegen von Kompartimenten) einer Zelle enthält die Gesamtheit aller freien A., welche dem Stoffwechsel jederzeit zur Verfügung stehen. Dieser Pool wird durch Nahrungsaufnahme, Proteolyse und de-novo-Synthese aufgefüllt. Die Aminosäuren des Aminosäurepools in einer Zelle werden dazu verwendet, Proteine zu synthetisieren, sie werden abgebaut oder sie dienen als Vorstufen für besondere Metabolite wie Hormone. Die Reaktionen der metabolischen Hauptwege sind: 1) Transaminierung zu 2-Oxosäuren, 2) Decarboxylierung, 3) Transformation der Seitenkette, 4) oxidative Desaminierung zu 2-Oxosäuren (Tab. 4).
Nichtproteinogene A. sind am Aufbau der Proteine gewöhnlich nicht beteiligt. Zu ihnen gehören auch A., die als Zwischenprodukte bei der Biosynthese proteinogener A. auftreten, z.B. δ-Aminoadipinsäure, Diaminopimelinsäure und Cystathionin. Man kennt heute 250 nichtproteinogene A., die zum größten Teil in Pflanzen vorkommen und hier jeweis auf bestimmte taxonomische Gruppen in ihrem Vorkommen begrenzt sind. Bezüglich ihrer Biosynthese lässt sich eine größere Anzahl den genannten vier Gruppen biogenetisch verwandter Aminosäurefamilien zuordnen. Einzelne nichtproteinogene A. sind in Ausnahmefällen auch in Proteinen nachgewiesen worden, z.B. L-Citrullin im Protein von Haarfollikeln und δ-Aminoadipinsäure im Maisprotein. Vorkommen und Verbreitung dieser seltenen natürlichen A. können für die Chemotaxonomie von Wert sein. Die Bezeichnung als seltene natürliche Aminosäure basiert auf ihrem nur sporadischen Vorkommen und ihrer von den proteinogenen A. abweichenden Struktur. Es gibt strukturelle Beziehungen zu den proteinogenen A. So kennt man mehr als 20 nichtproteinogene A., die sich lediglich duch Substitution eines Wasserstoffatoms der Methylgruppe des Alanins von dieser Aminosäure ableiten. Auch andere seltene natürliche A. lassen sich proteinogenen Stammaminosäuren zuordnen. Nichtproteinogene A. können auch als Antagonisten wirken. So ist z.B. die Azetidin-2-carbonsäure, die sich vom Prolin nur durch Ringverkleinerung um ein C-Atom unterscheidet, ein toxischer Bestandteil der einheimischen Maiglöckchen. Während es beim Maiglöckchen durch eine hochspezifische Prolyl-tRNA-Synthetase möglich ist, den unkontrollierten Einbau von Azetidin-2-carbonsäure in das arteigene Protein zu umgehen, kann bei anderen Organismen durch Täuschung des Proteinsyntheseapparates Azetidin-2-carbonsäure anstelle von Prolin in Proteine eingebaut werden, die dadurch in ihrer Tertiärstruktur und biologischen Aktivität verändert werden. Nichtproteinogene A. treten in bestimmten Pflanzenfamilien gehäuft auf, z.B. in Mimosengewächsen (Mimosaceae) L-α,β-Diaminopropionsäure und deren Derivate, Thioetherderivate von L-Cystein, Derivate des Lysins und der Glutaminsäure. Teilweise sind nichtproteinogene A. biologisch aktive Verbindungen, z.B. die lathyrinogenen Aminosäuren und Indospicin (L-2-Amino-6-amidinocapronsäure) aus Indigofera spicata, das als Lebergift wirkt und Missbildungen hervorruft.
Weitere Informationen über die einzelnen A. können unter dem entsprechenden Stichwort gefunden werden.
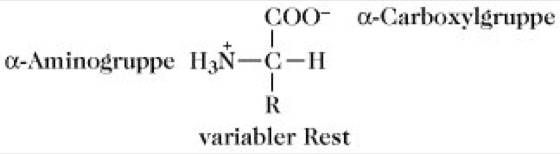
Aminosäuren. Abb. 1. Struktur einer α-Aminosäure.
Aminosäuren.Tab. 2. Aminosäuren, die durch posttranslationelle Modifizierung gebildet werden und nur in besonderen Proteinen vorkommen.
| ||
| δ-Hydroxy-L-lysin | Fischkollagen | |
| L-3,5-Dibromtyrosin | Skelett von Primnoa lepadifera (Koralle) | |
| L-3,5-Diiodtyrosin | Skelett von Gorgonia cavolinii (Koralle) | |
| L-3,5,3'-Triiodthyronin | Thyreoglobulin (Gewebsprotein der Schilddrüse) | |
| L-Thyroxin | Thyreoglobulin | |
| Hydroxy-L-prolin | Kollagen, Gelatine | |
| δ-Aminoadipinsäure | Maisprotein |
Aminosäuren. Tab. 1. Proteinogene Aminosäuren. Die Dreibuchstabenabkürzungen sind allgemein anerkannt und werden routinemäßig für Darstellungen von Protein- und Peptidsequenzen verwendet (Peptide). Die Einbuchstabenbezeichnung (vorgeschlagen von der IUPAC-IUB-Kommission für Biochemische Nomenklatur [Eur. J. Biochem. 5 (1968) 151-153] sollte für Veröffentlichungen von Sequenzen nicht verwendet werden. Es ist jedoch beabsichtigt, diese einzusetzen, um die Speicherung von Sequenzinformationen und die Durchführung von Sequenzvergleichen mit Hilfe des Computers zu erleichtern.
| ||||
| L-Alanin | Ala | A | I | |
| L-Arginin | Arg | R | IV | |
| L-Asparagin | Asn* | N* | II | |
| L-Asparaginsäure | Asp* | D* | III | |
| L-Cystein | Cys | C | II | |
| L-Glutamin | Gln | Q | II | |
| L-Glutaminsäure | Glu | E | III | |
| Glycin | Gly | G | I | |
| L-Histidin | His | H | IV | |
| L-Isoleucin | Ile | I | I | |
| L-Leucin | Leu | L | I | |
| L-Lysin | Lys | K | IV | |
| L-Methionin | Met | M | I | |
| L-Phenylalanin | Phe | F | I | |
| L-Prolin | Pro | P | I | |
| L-Serin | Ser | S | II | |
| L-Threonin | Thr | T | II | |
| L-Tryptophan | Trp | W | I | |
| L-Tyrosin | Tyr | Y | II | |
| L-Valin | Val | V | I | |
| Unbekannte oder andere | Xaa | X |
* Wenn nicht bekannt ist, ob die Aminosäure im ursprünglichen Protein als Asn oder Asp vorliegt, werden die Abkürzungen Asx oder B verwendet; Glx oder Z stehen für Glu, Gln, Gla (L-4-Carboxyglutaminsäure) oder Glp (Pyroglutaminsäure). Diese Zweideutigkeiten haben ihre Ursache darin, dass durch die chemische Hydrolyse der Peptidbindungen auch Asn, Gln, Gla und Glp zu den entsprechenden Säuren hydrolysiert werden.
Aminosäuren. Tab. 3. Minimalbedarf des Menschen an essenziellen Aminosäuren (mg/kg/Tag).
| ||||||||||
| Kind | 90,0 | .120,0 | 90,0 | 90,01) | 85,0 | . | 60,0 | 30,0 | 85,0 | |
| Mann | 10,4 | 9,9 | 8,8 | 4,32) 13,33) | 1,5 13,2* | 11,6 0,0 | 6,5 | 2,9 | 8,8 | |
| Frau | 5,2 | 7,1 | 3,3 | 3,14) | 4,7 | 0,5 | 3,5 | 2,1 | 9,2 | |
| Normen der WHO | 3,0 | 3,4 | 3,0 | 2,05) | 1,6 | 1,4 | 2,0 | 1,0 | 3,0 |
1) in Gegenwart von L-Tyrosin; 2) Tyr 15,9 mg/kg: Tyr/Trp = 5,5; 3) in Abwesenheit von L-Tyrosin; 4) Tyr 15,6 mg/kg: Tyr/Trp = 7,4; 5) Tyr 5,0 mg/kg: Tyr/Trp = 2,0. * 80-90 % des Methioninbedarfs kann durch Cystein gedeckt werden.
(WHO=World Health Organization, Weltgesundheitsorganisation).
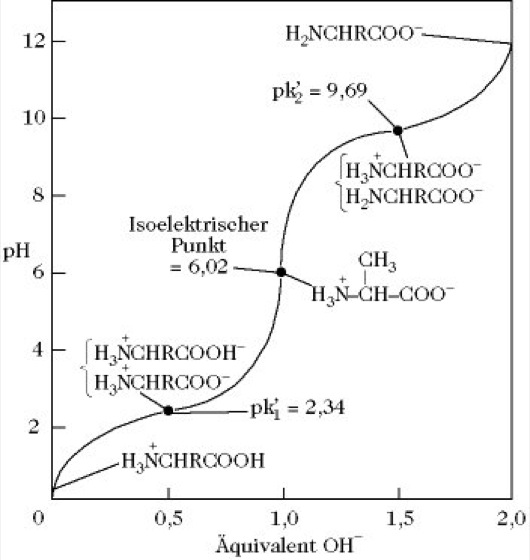
Aminosäuren. Abb. 2. Titrationskurve von Alanin.
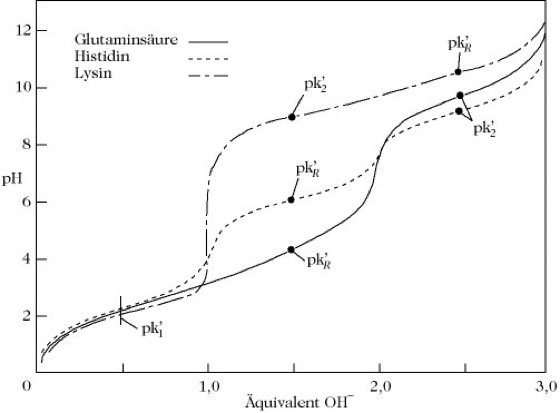
Aminosäuren.Abb. 3. Probentitrationskurven von Aminosäuren.

Aminosäuren.Abb. 4. Die Pyruvatfamilie der Aminosäuren.
Aminosäuren.Tab. 4. Metabolische Reaktionen der Aminosäuren.
| ||
| Transaminierung | 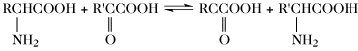 | |
| Decarboxylierung | 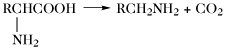 | |
| Aminierung | 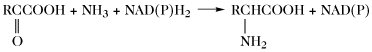 | |
| Desaminierung | 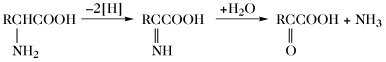 | |
| Modifizierung der Seitenkette | ||
| α-Hydroxylgruppe | ||
| α-Aminogruppe | ||
| α-Carboxylgruppe | ||
| Peptidbildung | 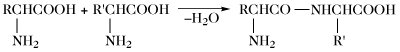 | |
| Aminosäureaktivierung | 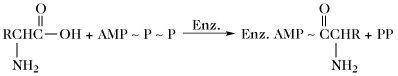 | |
| Aminosäuretransfer (Proteinbiosynthese) (Bildung von Aminoacyl-tRNA, aatRNA) | 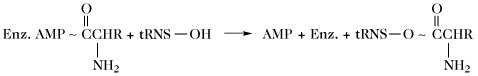 | |
| Gramicidin-S-Synthese (Thioesterbildung) | 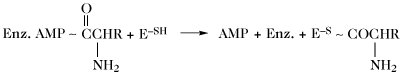 | |
| Enz. = Enzym; E = Protein II der Gramicidin-S-Synthetase. |
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.