Lexikon der Biochemie: Komplementsystem
Komplementsystem, ein hitzelabiles (100 %ige Inaktivierung nach 30 Min bei 56°C) Kaskadensystem im Serum aller Vertebraten. Es besteht bei Säugetieren aus mindestens 20 Glycoproteinen, von denen sieben die Lokalisierung der Wirkung regulieren. Jede aktivierte Komponente (oder jeder aktivierte Komplex) ist eine hochspezifische Protease, die nur auf die nächste Komponente der Kaskade wirkt. Es sind zwei Wege bekannt, der klassische und der alternative. Der klassische Weg wird durch die Bindung von C1 an Immunkomplexe, die IgG oder IgM enthalten [die C1-Bindungsstellen sind in der Fc-Region von IgG und IgM (Immunglobuline) lokalisiert; die Bindung ist Ca2+-abhängig], aktiviert. C1 besteht aus drei Untereinheiten: C1q, C1r und C1s. Die Bindungsstellen für IgG und IgM liegen auf C1q. Die Besetzung dieser Bindungsstellen verleiht der Untereinheit proteolytische Aktivität, wodurch eine einzelne Peptidbindung auf C1r gespalten wird. Die auf diese Weise aktivierte C1r-Untereinheit hydrolysiert ihrerseits eine Peptidbindung auf C1s. Dadurch wird der vollständig aktive C1-Komplex erhalten, der die aufeinanderfolgende Ansammlung von zirkulierenden Komponenten zu einem oberflächengebundenen Proteinkomplex initiiert (Abb. 1). Der alternative Weg wird durch eine Vielzahl von Aktivatoren initiiert, einschließlich Antikörpern (IgA und IgE, die nach Komplexierung mit einem Antigen nicht den klassischen Weg aktivieren), Polysacchariden mit hohem Mr von Bakterien und Hefen, Bruchstücken von Pflanzenzellwänden und Protozoen. Es wird angenommen, dass dieser Weg für die einleitende Reaktion auf das Eindringen von Bakterien sorgt, da er in Abwesenheit von Antikörpern aktiviert wird. Der Faktor D des alternativen Weges ist auch in nichtaktiviertem Serum proteolytisch aktiv, d.h. seine Bildung aus einer inaktiven Vorstufe ist nicht Teil des Kaskadenverstärkungssystems.
Früh auftretende Komponenten jedes Wegs sind in erster Linie an der Bildung von zwei Proteinkomplexen beteiligt, die entweder als C3- oder C5-Konvertasen fungieren. Die proteolytische Aktivierung von C5 stellt den letzten enzymatischen Schritt dar, der den spontanen Zusammenschluss der später gebildeten Komponenten (C6-C9) zu einem nichtenzymatischen lytischen Komplex auslöst, der in der Lage ist, Zellmembranen zu durchbohren (Abb. 1 und 2). Daraus folgt, dass die Hauptaufgabe des Komplementsystems darin besteht, fremde invasive Zellen aufzulösen. Trotz der anaphylatoxischen und chemotaktischen Eigenschaften einiger Komponenten (besonders C3a, C4a und C5a) bleiben die fremden Zellen empfänglich für die Phagocytose. Das K. ist außerdem an der Solubilisierung von Immunkomplexen und an der Entwicklung der zellulären Immunantwort beteiligt. Das Fehlen von Komponenten des K. ist von wiederholten bakteriellen Infekten begleitet und wird mit bestimmten Autoimmunkrankheiten in Verbindung gebracht.
Die Aminosäuresequenzen der meisten Komponenten des K. wurden mit Hilfe einer Kombination von Protein- und cDNA-Sequenzierungstechniken bestimmt.
Für experimentelle Zwecke wird das Serum von Meerschweinchen oder von Patienten, denen aufgrund eines genetischen Defekts eine Komponente fehlt, als Komplementsystemquelle (hämolytisches System) verwendet. Sensibilisierte Schafserythrocyten dienen als Immunaggregate für die Untersuchung des klassischen Weges, während Kaninchenerythrocyten für den alternativen Weg genutzt werden. [R.R. Porter, P.J. Lachmann u. K.B.M. Reid (Hrsg.) Biochemistry and Genetics of Complement, Cambridge University Press, 1986]
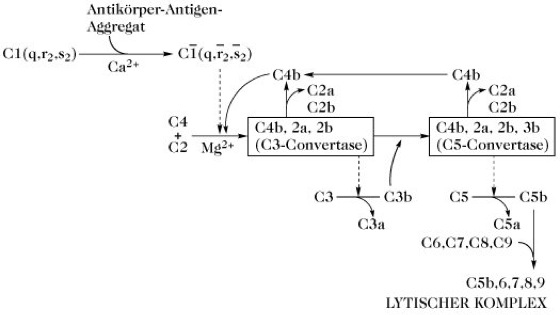
Komplementsystem. Abb. 1. Klassischer Weg der Komplementaktivierung. Ein Balken über der Ziffer oder dem Buchstaben eines Faktors zeigt, dass der Faktor aktiviert (d.h. proteolytisch aktiv) ist. Die Aktivierung durch Proteolyse erfolgt nahe dem N-Ende, wodurch ein kleines (a) und ein großes (b) Spaltungsprodukt entsteht, z.B. C3 → C3a + C3b.
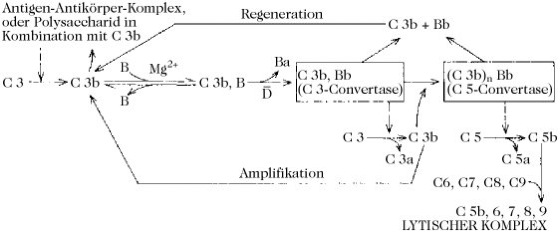
Komplementsystem. Abb. 2. Der alternative Weg der Komplementaktivierung. s. Legende zu Abb. 1.
Wenn Sie inhaltliche Anmerkungen zu diesem Artikel haben, können Sie die Redaktion per E-Mail informieren. Wir lesen Ihre Zuschrift, bitten jedoch um Verständnis, dass wir nicht jede beantworten können.